Sinkfingre, struktur, klassifisering, funksjon
- 2198
- 50
- Mathias Aas
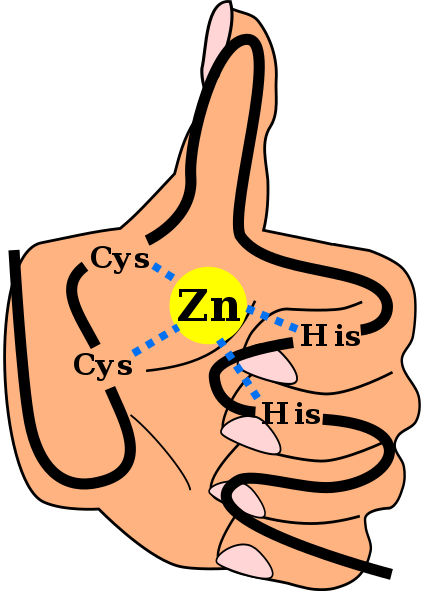
 Primærstruktur av et sinkfingerdomene C2H2, inkludert koblingene som koordinerer sinkionet og med en bakgrunn av "hånd og finger". Angel Herraez, Wikimedia Commons
Primærstruktur av et sinkfingerdomene C2H2, inkludert koblingene som koordinerer sinkionet og med en bakgrunn av "hånd og finger". Angel Herraez, Wikimedia Commons De Sinkfingre (ZF) er strukturelle motiver som er til stede i et stort antall eukaryoter. De tilhører metalloproteingruppen, ettersom de er i stand til å forene sinkmetallionet, som de krever for dens drift. Det er spådd at mer enn 1500 ZF -domener eksisterer i rundt 1000 forskjellige proteiner hos mennesker.
Begrepet sinkfinger eller "sinkfinger" ble først myntet i 1985 av Miller, McLachlan og Klug, mens han i detalj studerte de små domenene til DNA fra DNA fra transkripsjonsfaktoren TFIIIA av Xenopus laevis, beskrevet av andre forfattere noen år før.
Proteiner med ZF -motiv er de mest tallrike i genomet til eukaryote organismer og deltar i mangfold av essensielle cellulære prosesser, blant hvilke genetisk transkripsjon, oversettelse av proteiner, metabolisme, folding og montering av andre proteiner og lipider skiller seg ut, programmert celledød, blant blant andre.
Struktur
Strukturen til ZF -motivene er ekstremt bevart. Vanligvis har disse gjentatte regionene 30 til 60 aminosyrer, hvis sekundære struktur er som to beta -antiparallelle ark som danner en gaffel og en alfa -proxy, som er betegnet som ββα.
Denne sekundære strukturen er stabilisert ved hydrofobe interaksjoner og ved koordinering av et sinkatom gitt av to cystein og to histidinavfall (Cys2Hans2). Imidlertid er det ZF som kan koordinere mer enn ett sinkatom og andre der rekkefølgen av Cys og hans avfall varierer.
Kan tjene deg: palmitholeinsyre: struktur, funksjoner, hvor er detZFS kan gjentas i batch, lineært konfigurert i samme protein. Alle har lignende strukturer, men de kan differensiere seg kjemisk ved varianter av nøkkel aminosyreavfall for oppfyllelse av funksjonene deres.
Et vanlig kjennetegn mellom ZF er dens evne til å gjenkjenne DNA- eller RNA -molekyler i forskjellige lengder, og det er grunnen til at de opprinnelig ble ansett bare for transkripsjonsfaktorer.
Generelt er gjenkjennelsen 3PB -regioner i DNA og oppnås når proteinet med ZF -domene presenterer alfa -propellen til hovedsporet til DNA -molekylet.
Klassifisering
Det er forskjellige ZF -årsaker som skiller seg fra hverandre etter deres natur og de forskjellige romkonfigurasjonene som oppnår koordinasjonsforbindelser med sinkatomet. En av klassifiseringene er som følger:
C2H2
Dette er en grunn som ofte finnes i ZF. De fleste grunner c2H2 De er spesifikke for interaksjon med DNA og RNA, men de har blitt observert å delta i protein-protein-interaksjoner. De har mellom 25 og 30 aminosyreavfall og er innenfor den største familien av regulatoriske proteiner hos pattedyr.
C2H
Samhandle med RNA og noen andre proteiner. De blir hovedsakelig observert som en del av noen proteiner fra retrovirus -kapsid, og samarbeider i emballasjen til det virale RNA like etter replikasjonen.
C4 (loop eller tape)
Proteiner med dette motivet er enzymer som er ansvarlige for replikasjon og transkripsjon av DNA. Et godt eksempel på disse kan være de rå enzymer av fag T4 og T7.
C4 (Gata -familie)
Denne ZF -familien inkluderer transkripsjonsfaktorer som regulerer uttrykket av viktige gener i mange vev under celleutvikling. Gata-2 og 3 faktorer er for eksempel involvert i hematopoiesis.
Det kan tjene deg: ATP (adenosin triffosfat)C6
Disse domenene er typiske for gjær, nærmere bestemt GAL4 -proteinet, som aktiverer transkripsjon av gener som er involvert i bruken av galaktose og melibisk.
Sinkfingre (C3HC4-C3H2C3)
Disse spesielle strukturene har 2 ZF -domeneundertyper (C3HC4 og c3H2C3) og er til stede i en rekke dyre- og planteproteiner.
De finnes i proteiner som Rad5, involvert i DNA -reparasjon i eukaryote organismer. De finnes også i RAG1, uunnværlig for omkonfigurasjon av immunoglobuliner.
H2C2
Dette ZF -domenet er sterkt bevart i retrovirus og retrotransposon -integraler; Når du blir med i hvitt protein, forårsaker det konformasjonsendring i det samme.
Funksjoner
ZF -domener proteiner tjener forskjellige formål: de kan finnes i ribosomale proteiner eller transkripsjonsadaptere. De har også blitt påvist som en integrert del av strukturen til RNA -polymerase II av gjær.
De ser ut til å være involvert i intracellulær sinkhomeostase og i regulering av apoptose eller programmert celledød. I tillegg er det noen ZF -proteiner som fungerer som chaperones for folding eller transport av andre proteiner.
Lipidunion og en grunnleggende rolle i protein-protein-interaksjoner er også enestående funksjoner av ZF-domener i noen proteiner.
Bioteknologisk betydning
Gjennom årene har den strukturelle og funksjonelle forståelsen av ZF -domener tillatt store vitenskapelige fremskritt som innebærer bruk av deres egenskaper til bioteknologiske formål.
Siden noen ZF -proteiner har en stor spesifisitet på grunn av visse DNA -domener, investeres for tiden mye innsats i den spesifikke ZF -designen, som kan gi verdifulle fremskritt innen genterapi hos mennesker.
Det kan tjene deg: Kinas flora og fauna: Representative arterInteressante bioteknologiske anvendelser oppstår også fra proteinutformingen med ZF modifisert av genetisk ingeniørfag. Avhengig av ønsket ende, kan noen av disse modifiseres ved tilsetning av fingre med "poli sink" fingre, som er i stand til å gjenkjenne en hvilken som helst sekvens av DNA med stor affinitet og spesifisitet.
Den genomiske utgaven med modifiserte Nucleas er en av de mest lovende applikasjonene i dag. Denne typen utgave gir muligheten for å gjennomføre studier om genetisk funksjon direkte i interesseanlegget.
Genteknologi ved bruk av modifiserte ZF Nucleasas har fanget oppmerksomheten til forskere innen genetisk forbedring av kultivarer av agronomisk betydning. Disse nukleasene har blitt brukt for å korrigere et endogent gen som produserer ugressmidler -resistente former i tobakksplanter.
Nucleas med ZF har også blitt brukt til tilsetning av gener i pattedyrceller. De aktuelle proteiner ble brukt til å generere et sett med isogene museceller med en serie alleler definert for et endogent gen.
En slik prosess har en direkte anvendelse i merkingen og opprettelsen av nye alleliske former for å studere struktur- og funksjonsrelasjoner i naturlige uttrykksforhold og i isogene miljøer.
Referanser
- Berg, J. M. (1990). Sinkfingerdomener: Hypoteser og nåværende kunnskap. Årlig gjennomgang av biofysikk og biofysisk kjemi, 19(39), 405-421.
- Kluska, k., Adamczyk, J., & Krȩzel, a. (2017). Metallbindende egenskaper til sinkfingre med et naturlig alten metallbindingssted. Metallomics, 10(2), 248-263.

