Halogenerte derivater

- 3064
- 3
- Anders Mathisen
Vi forklarer hva de halogenerte derivater, deres egenskaper, bruksområder/applikasjoner er, og vi gir flere eksempler
Hva er halogenerte derivater?
De Halogenerte derivater De er alle forbindelser som har et halogenatom; Det vil si at noen av elementene i gruppe 17 (F, CL, BR, I). Disse elementene skiller seg fra resten fordi de er mer elektronegative, og danner et mangfold av uorganiske og organiske halogenider.
Det nedre bildet av halogener vises i det nedre bildet. Fra topp til bunn: Fluor (f2), Klor (cl2), Bromo (BR2) og jod (jeg2). Hver av disse har evnen til å reagere med de aller fleste elementene, inkludert mellom kongener i samme gruppe (interhalogener).

Dermed har halogenerte derivater en MX -formel hvis det er en metallhaluro, RX hvis det er alkyl og ARX hvis det er aromatisk. De to siste er lokalisert i kategorien Organic Haluros. Stabiliteten til disse forbindelsene krever en "fordel" foran det originale brusmolekylet.
Som en generell regel danner fluoren halogenert mer stabil enn jod. Årsaken skyldes forskjellene mellom atomradioene deres (de lilla kulene er mer klumpete enn de gule).
Ved å øke atomradiusen er overlappingen av orbitalene mellom halogenet og det andre atomet dårligere, og derfor er koblingen svakere.
Nomenklatur
Måten å navngi disse forbindelsene på riktig måte avhenger av om de er uorganiske eller organiske.
Uorganisk
Metalliske halogenider består av en binding, ionisk eller kovalent, mellom et halogen X og et M -metall (av gruppe 1 og 2, overgangsmetaller, tungmetaller, etc.).
I disse forbindelsene har alle halogener en oksidasjonstilstand på -1. Fordi? Fordi dens Valencia -konfigurasjoner er NS2Np5.
Derfor må de bare vinne ett elektron for å fullføre oktetten av Valencia, mens metallene oksiderer, og gir dem elektronene de har.
Kan tjene deg: presisjonsbalanse: egenskaper, funksjoner, deler, brukSåledes forblir fluor som f-, fluor; CL-, klorid; Br-, bromid; og jeg-, jeg Varer. MF ville bli navngitt: Fluor av (metallnavn) (n), som n Valencia del metal bare når det har mer enn en. Når det gjelder grupper av gruppe 1 og 2, er det ikke nødvendig å navngi Valencia.
Eksempler
- NAF: natriumfluorid.
- Cacl2: kalsiumklorid.
- AGBR: Sølvbromid.
- Zni2: Sink Yoduro.
- CUCL: Kobberklorid (i).
- Cucl2: Kobberklorid (ii).
- Ticl4: Titanklorid (IV) eller Titano tetraklorid.
Imidlertid kan hydrogen- og ikke -metallelementer - selv de samme halogenene - også danne haluros. I disse tilfellene utnevnes ikke Valencia of the No Metal på slutten:
- PCL5: Fosforpentaklorid.
- Bf3: Boro Trifluoruro.
- Ali3: Aluminium Triyoduro.
- HBR: Hydrogenbromid.
- Hvis7: jod heptofluorid.
Organisk
Uansett om Rx eller ARX, er halogenet kovalent knyttet til et karbonatom. I disse tilfellene er halogener nevnt med navnene deres, og resten av nomenklaturen avhenger av molekylstrukturen til R eller AR.
For det enkleste organiske molekylet, metan (Cho4) Følgende derivater oppnås ved å erstatte H med CL:
- Ch3CL: Klormetan.
- Ch2Cl2: diklormetan.
- CHCL3: Tricylormethane (kloroform).
- CCL4: Tetraklormetan (karbonklorid (IV) eller karbontetraklorid).
Her består R av et enkelt karbonatom. Så, for andre alifatiske kjeder (lineære eller grener), telles antallet karbonatomer som det er knyttet til halogenet:
Ch3Ch2Ch2F: 1-fluorpropano.
Det forrige eksemplet var det av en primær alquilisk halogenid. I tilfelle kjeden er forgrenet, velges den lengste som inneholder halogenet og begynner å telle, og etterlater dette som mulig nummer:
Kan tjene deg: Hva er de fysiske egenskapene til materie?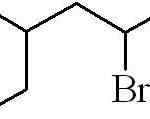
3-metyl-5-bromheksan
På samme måte som det oppstår for andre substituenter. Også for de aromatiske halogenidene er halogenet utnevnt og deretter resten av strukturen:

Det overordnede bildet viser forbindelsen som kalles brombenzen, og fremhever bromatomet i brunt.
Egenskaper til halogenerte derivater
Uorganiske halogenider
Uorganiske halogenider er ioniske eller molekylære faste stoffer, selv om de førstnevnte er rikere. Avhengig av interaksjoner og ioniske radioer til MX, vil dette være oppløselig i vann eller andre mindre polare løsningsmidler.
Ikke -metalliske halogenider (for eksempel boro) er vanligvis Lewis -syrer, noe som betyr at de aksepterer elektroner for å danne komplekser. På den annen side produserer halogenider (eller halogenuros) av hydrogen oppløst i vann det som kalles hydracider.
Smeltepunktene, kokende eller sublimering faller på elektrostatisk eller kovalent interaksjoner mellom metall eller ikke -metall med halogen.
På samme måte spiller ioniske radioer en viktig rolle i disse egenskapene. For eksempel, hvis m+ og x- De har lignende størrelser, krystallene deres vil være mer stabile.
Organiske halogenider
De er polare. Fordi? Fordi forskjellen i elektronegativiteter mellom C og halogen skaper et permanent polært øyeblikk i molekylet. Dette avtar også når gruppe 17 stiger ned, fra C-F-lenken til C-I.
Uten å vurdere molekylstrukturen til R eller AR, påvirker de voksende halogenantallene direkte kokepunktene, siden de øker molmassen og intermolekylære interaksjoner (RC-X-X-CR). De fleste er ikke blandbare med vann, men de kan oppløses i organiske løsningsmidler.
Bruk av halogenerte derivater
Bruken av halogenerte derivater kan reservere sin egen tekst. De molekylære "følgesvennene" av halogener er en nøkkelfaktor, gitt at deres egenskaper og reaktiviteter definerer bruken av derivatet.
Kan tjene deg: Kaliumsulfat (K2SO4): Struktur, egenskaper, bruksområder, synteseDermed skiller seg ut blant det store mangfoldet av mulige bruksområder:
- Molekylære halogener brukes til å lage halogenpærer, der du kommer i kontakt med det glødende wolframfilamentet. Hensikten med denne blandingen er å reagere Halogen X med det fordampede wolfram. På denne måten unngås avsetningen på overflaten av pæren, og garanterer mer levetid.
- Fluorursalter brukes i fluoriseringen av tannfarvann og pastaer.
- Natrium- og kalsiumhypokloritter er to aktive midler i kommersielle blekingsløsninger (klor).
- Selv om de forverrer ozonlaget, brukes klorfluorokarboner (CFC) i aerosoler og kjølesystemer.
- Vinylklorid (Cho2= CHCl) er monomeren til polyvinylpolymerklorid (PVC). På den annen side består teflon, brukt som ikke -pinne -materiale, av polymerkjeder av tetrafluoretylen (f2C = jfr2).
- De brukes i analytisk kjemi og organisk syntese til forskjellige formål; Blant disse, medikamentsyntese.
Ytterligere eksempler

Det overordnede bildet illustrerer skjoldbruskkjertelhormonet, ansvarlig for varmeproduksjon så vel som økningen i generell metabolisme i kroppen. Denne forbindelsen er et eksempel på et halogenert derivat som er til stede i menneskekroppen.
Blant andre halogenerte forbindelser er følgende nevnt:
- Diclorodifenilriclorootan (DDT), effektivt insektmiddel, men med alvorlige miljøpåvirkninger.
- Tinnklorid (snncl2), brukt som et reduserende middel.
- Kloretan eller 1-kloretan (CH3Ch2Cl), aktuell bedøvelse som virker raskt avkjøling av huden.
- Dikloretylen (CLCH = CCLH) og tetrachloretylen (CL2C = CCL2), brukt som løsningsmidler i renseriindustrien.
- « Silisiumkarbid kjemisk struktur, egenskaper og bruk
- 80 setninger for den første kjærligheten som aldri glemmer »

