Deuterium
- 4501
- 497
- Prof. Joakim Johansen
Hva er deuteriet?
Han Deuterium Det er en av de isotopiske artene av hydrogen, som er representert som D eller 2H. I tillegg har navnet på tungt hydrogen blitt gitt, fordi dens masse er dobbelt så mye som proton. En isotop er en art som kommer fra det samme kjemiske elementet, men hvis massetall er forskjellig fra dette.
Denne skillet skyldes forskjellen i antall nøytroner den har. Deuterium regnes som en stabil isotop og kan finnes i forbindelser dannet av hydrogen av naturlig opprinnelse, selv om det i en ganske liten andel (mindre enn 0,02 %).
Gitt den.
Av denne og andre grunner har denne isotopen mange applikasjoner på forskjellige vitenskapsområder, og blir en av de viktigste.
Deuteriumstruktur
Strukturen i deuteriet utgjør hovedsakelig av en kjerne som har et proton og et nøytron, med en atomvekt eller masse på omtrent 2.014 g.
Tilsvarende skylder denne isotopen sin oppdagelse til Harold C. Urey, en kjemiker fra USA, og dens samarbeidspartnere Ferdinand Brickwedde og George Murphy, i 1931.

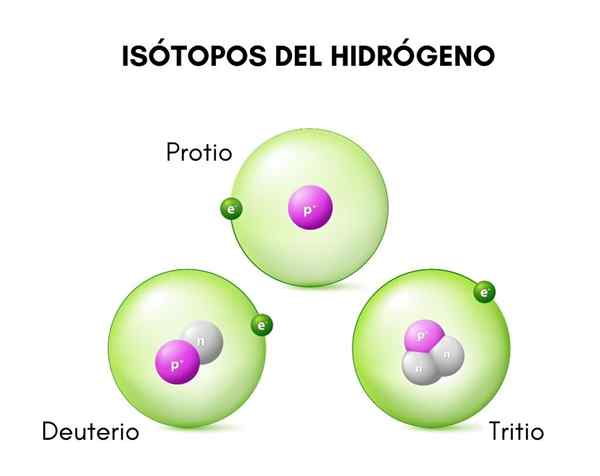
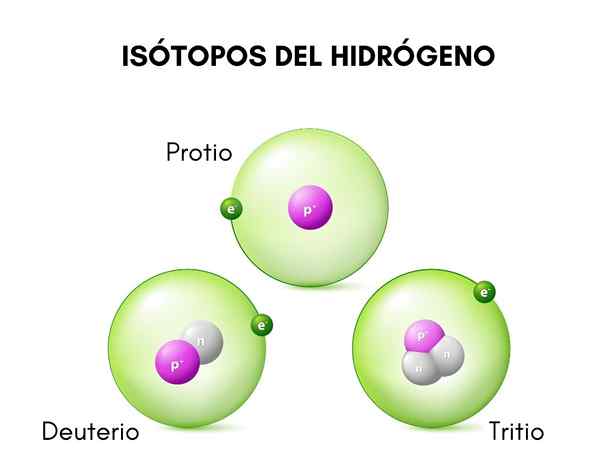
I det øvre bildet kan du se sammenligningen mellom strukturene til isotoper av hydrogen, som finnes i protioform (dets mest tallrike isotop), deuterium og tritium, bestilt fra venstre til høyre.
Forberedelsen av deuteriet i sin rene tilstand ble utført med suksess for første gang i 1933, men siden 1950 -tallet har et fastfasestoff blitt brukt og det har vist stabilitet, kalt litiumdeuterid (lokk), for erstatning Deuterium og tritium i Et stort antall kjemiske reaksjoner.
Kan tjene deg: Kloroksid (III): egenskaper, struktur, brukI denne forstand har overflod av denne isotopen blitt studert, og det har blitt observert at andelen i vannet kan variere litt, avhengig av kilden som prøven er tatt.
I tillegg, gjennom spektroskopiundersøkelser, er eksistensen av denne isotopen på andre planeter av denne galaksen blitt bestemt.
Noen data om deuterium
Den grunnleggende forskjellen mellom isotoper av hydrogen (som er de eneste som har blitt navngitt på forskjellige måter) ligger i deres struktur, fordi mengden protoner og nøytroner av en art gir dens kjemiske egenskaper.
På den annen side elimineres det eksisterende deuteriet inne i de stellar kroppene med en raskere hastighet enn det er oppstått.
I tillegg anses det at andre naturfenomener bare danner en veldig liten mengde av den, så produksjonen fortsetter å generere interesse i dag.
Tilsvarende har en serie undersøkelser avdekket at de aller fleste atomer som har dannet seg av denne arten, har sin opprinnelse i Big Bang; Dette er grunnen til at tilstedeværelsen på store planeter som Jupiter blir advart.
Ettersom den vanligste måten å oppnå denne arten i naturen på er når den er kombinert med hydrogen i form av protio, blir interessens interesse fortsatt vekket av forholdet som er etablert mellom andelen av begge artene i forskjellige vitenskapsfelt, slik som astronomi eller vær.
Kan tjene deg: Renio: oppdagelse, egenskaper, struktur, brukDeuteriumegenskaper
- Det er en isotop som mangler radioaktive egenskaper; det vil si at det er ganske stabilt.
- Det kan brukes til å erstatte hydrogenatom i kjemiske reaksjoner.
- Denne arten manifesterer en annen oppførsel enn vanlig hydrogen i biokjemiske reaksjoner.
- Når de to hydrogenatomene erstattes i vannet, oppnås D2Eller, å skaffe seg navnet på tungt vann.
- Hydrogenet som er til stede i havet som er i form av deuterium eksisterer i en andel på 0,016 % i forhold til protio.
- I stjernene har denne isotopen en tendens til å smelte sammen for å gi opphav til helium.
- D2Eller utgjør en giftig art, selv om dens kjemiske egenskaper er veldig lik de av H2
- Når deuteriumatomer blir utsatt for kjernefusjonsprosessen ved høye temperaturer, oppnås løsgjøring av store mengder energi.
- Fysiske egenskaper som kokepunkt, tetthet, fordampningsvarme, trippelpunkt, blant andre, har store størrelser i deuteriummolekyler (D2) at i hydrogen (h2).
- Den vanligste måten det finnes er knyttet til et hydrogenatom, noe som forårsaker hydrogendeuterid (HD).
Bruk/applikasjoner
På grunn av dens egenskaper brukes deuteriet i en lang rekke applikasjoner der hydrogen er involvert. Noen av disse bruksområdene er beskrevet nedenfor:
- Innen biokjemi brukes det i den isotopiske merkingen, som består av "markering" en prøve med isotopen valgt for å spore den gjennom passasjen gjennom et gitt system.
Kan tjene deg: sterk syre- I atomreaktorer som utfører fusjonsreaksjoner, brukes det til å redusere hastigheten som nøytroner beveger seg uten den høye absorpsjonen av disse som den vanlige hydrogenen presenterer.
- I området kjernefysisk magnetisk resonans (NMR) brukes løsningsmidler basert på deuterium for å oppnå prøver av denne typen spektroskopi uten tilstedeværelse av interferens som produseres ved bruk av hydrogenerte løsningsmidler.
- I feltet biologi studeres makromolekyler gjennom nøytron -spredningsteknikker, der prøvene utstyrt med deuterium brukes til å redusere støy betydelig i disse kontrastegenskapene.
- I farmakologiområdet brukes hydrogenerstatning av deuterium med den kinetiske isotopiske effekten som genereres og lar disse medisinene ha en lengre halvliv.