Dibenzalacetona -egenskaper, reaksjonsmekanisme, bruksområder, risikoer

- 3635
- 1082
- Thomas Karlsen
De Dibenzalacetona (DBA) er en organisk forbindelse hvis molekylære formel er C17H14ENTEN. Det er et gulaktig fast stoff som, avhengig av dens renhet, kan presenteres som krystaller. Det brukes i solkremer og organomethalisk syntese der paladiet brukes som katalysator.
Mens syntesen er en relativt enkel, ganske tilbakevendende prosess i å undervise laboratorier for å forklare aldolisk kondens, er mekanismen litt omfattende, bør flere faktorer tas i betraktning. Benzaldehydet som brukes, som vil kondensere med aceton, må nylig destilleres for å garantere den lave oksidasjonen i kontakt med luften.
 Dibenzalacetona prøve i glassbeholder. Kilde: Stephanb [CC BY-SA (http: // CreativeCommons.Org/lisenser/by-SA/3.0/]]
Dibenzalacetona prøve i glassbeholder. Kilde: Stephanb [CC BY-SA (http: // CreativeCommons.Org/lisenser/by-SA/3.0/]] På samme måte brukes et etanolvannsmedium til å solubilisere reagensene og samtidig fremme den endelige nedbøren av dibenzalaceton, hydrofob og uoppløselig forbindelse. Så langt er det ikke kjent hvilke negative effekter som kan utøve Dibenzalaceton på organismen eller miljøet, i stedet for å være et irriterende stoff.
[TOC]
Egenskaper
Fysisk utseende
Solid gulaktig støvete eller krystallinsk utseende.
Molmasse
234,29 g/mol
Isomerer
Dibenzalacetone presenteres som tre geometriske isomerer: Trans-Trans-Trans-CIS og CIS-CIS. Trans-trans-isomeren er alle mest stabile, og derfor den som oppstår mest under syntesen.
Smeltepunkt
110-111 ºC. Dette området varierer avhengig av renhetsgraden av det syntetiserte faststoffet.
Vannløselighet
Uoppløselig.
Struktur
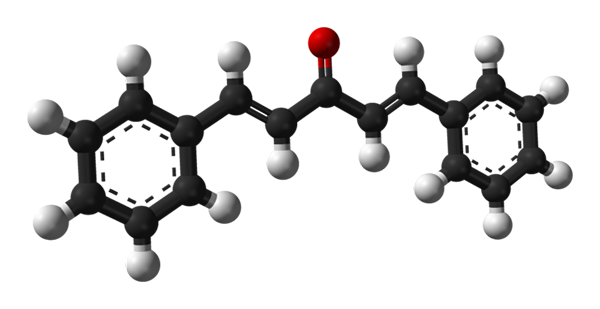 Molekylær struktur av dibenzalaceton. Kilde: Benjah-BMM27 [Public Domain]
Molekylær struktur av dibenzalaceton. Kilde: Benjah-BMM27 [Public Domain] I det øvre bildet vises molekylet til trans-trans-trans-isomeren. I midten av den har vi karbonylgruppen, og på sidene, dobbeltbindinger og to aromatiske bonencen -ringer.
Dibenzalacetone er i apolar og hydrofob essens, siden hele strukturen er praktisk talt sammensatt av karbon- og hydrogenatomer. Karbonylgruppen gir den bare et lite dipolmoment.
Kan tjene deg: aluminiumfosfuro (AIP): struktur, egenskaper, bruksområder, risikoStrukturen kan likestilles med et ark, siden alle karbonatomer har SP -hybridisering2; Derfor hviler de i samme plan.
Lysfotoner samhandler med det konjugerte π -systemet i Dibenzalacetona; Spesielt de med UV -stråling, og blir absorbert for å begeistre flyttede elektroner. Denne eiendommen gjør Dibenzalacetona til en utmerket absorberende av ultrafiolett lys.
Dibenzalacetona reaksjonsmekanisme
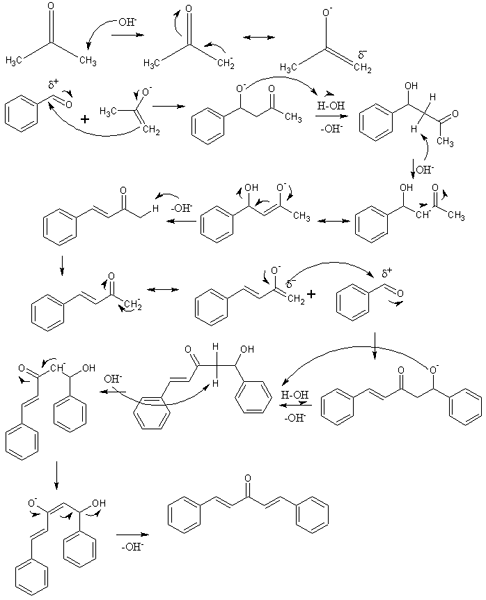 Mekanisme for aldolisk kondens i syntesen av Dibenzalacetona. Kilde: Izmaelt [CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)]
Mekanisme for aldolisk kondens i syntesen av Dibenzalacetona. Kilde: Izmaelt [CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)] I det overlegne bildet har vi representert mekanismen for aldolisk kondens mellom benzaldehyd og aceton, for å stamme Dibenzalaceton; Spesielt dens trans-trans-isomer.
Reaksjonen begynner med aceton i basismedium. ÅH- Unswide et syreproton av en av de to metylgruppene, -CH3, gir opphav til et inolat: cho3C (O) CH2-, som flytter sin negative resonansbelastning (første rad i bildet).
Dette inolatet fungerer da som et nukleofilt middel: angriper karbonylgruppen til et benzaldehydmolekyl. Dets inkorporering i benzaldehydet genererer et alcoxide, som fordi det er veldig grunnleggende ødeleggende et vannmolekyl og blir en aldol (andre rad). Aldol eller β-hydroxychithon er preget av å ha grupper C = O og OH.
Det grunnleggende medium dehydrater Denne aldol og en dobbeltbinding dannes i strukturen, som genererer benzylidenaceton (tredje rad). Da, åh- Også uprotrous et av sine sure hydrogener, og gjentar et annet nukleofilt angrep på et andre benzaldehydmolekyl. Denne gangen finner angrepet like raskt (fjerde rad).
Produktet dannet ubeskyttet et annet vannmolekyl og lider igjen en dehydrering for å eliminere OH -gruppen og etablere en andre dobbeltbinding (femte og sjette rader). Dermed og til slutt oppstår Dibenzalacetona.
Kan tjene deg: Boyle LawSyntese
Reagenser
Reagensene for å utføre syntesen av Dibenzalaceton er følgende:
- 95% etanol.
- Nylig destillert benzaldehyd av bitter mandelolje.
- NaOH som en grunnleggende katalysator i destillert vann.
Beløpene som skal brukes avhenger av hvor mye Dibenzalacetone det er ment å syntetisere. Imidlertid er det et overskudd av benzaldehyd, fordi en del av det oksideres til benzosyre. Det er også garantert at reaksjonen tar kortere tid og at den uønskede benzylideneaceton produseres i mindre grad.
Etanol fungerer som et løsningsmiddel av benzaldehyd, siden det ellers ikke ville oppløses i det grunnleggende miljøet i NaOH.
Fremgangsmåte
I et stort bunnfall glass blandes etanol med benzaldehyd. Deretter tilsettes det grunnleggende mediet til NaOH under konstant magnetisk omrøring. I dette trinnet oppstår cannizzaro -reaksjonen; Det vil si at to benzaldehydmolekyler uforholdsmessige seg i en av benzylalkohol og en annen av benzosyre, lett gjenkjennelig av dens karakteristiske søte lukt.
Endelig blir aceton tilsatt og en halv time forventes at løsningen blir overskyet og en gul-oransje farge. Dibenzalacetona vil utfelle på grunn av vann, så et betydelig vannvolum tilsettes for å fremme dets fullstendige nedbør.
Dibenzalacetona filtre inn i et vakuum og det gulaktige faststoffet var lava flere ganger med destillert vann.
Omkrystallisering
 En omkrystallisert prøve av Dibenzalacetona må ha en glans som ligner på krystallene til dette bildet. Kilde: Smokefoot [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]
En omkrystallisert prøve av Dibenzalacetona må ha en glans som ligner på krystallene til dette bildet. Kilde: Smokefoot [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)] For å rense dibenzalaceton brukes 95% etanol eller varmt etylacetat, slik at flere renhetskrystaller oppnås for hver gang omkrystallisering gjentas. Dermed vil det første gulaktige støvet bli omgjort til små gule krystaller av Dibenzalacetona.
Kan tjene deg: Benzosyre (C6H5COOH)applikasjoner
Dibenzalacetona er en forbindelse som ikke har for mange bruksområder. På grunn av dens evne til å absorbere ultrafiolett lys, brukes det i formuleringen av solkrem, eller noe annet produkt som plager forekomsten av UV -stråler, enten belegg eller malerier.
På den annen side brukes Dibenzalacetone i organometallisk syntese av paladiet. Det fungerer som en binding som koordinerer metalliske paladiumatomer, PD0, For å danne Tris -komplekset (DibenzenaCetona) Dipaladio (0).
Denne organometalliske forbindelsen gir PD -atomer0 I forskjellig organisk syntese, så oppfører den seg som en homogen katalysator, siden den oppløses i mange organiske løsningsmidler.
På samme måte er Dibenzalacetona som bindemiddel lett å erstatte med andre organiske bindemidler, som lar organometallisk syntese av paladiet utvikle seg.
Risiko
Når det gjelder risikoen, er det ikke mye tilgjengelig informasjon som rapporterer om mulige innvirkninger på helse eller miljø som kan føre til Dibenzalacetone. I sin rene tilstand er det et irriterende fast stoff for inntak, pust eller direkte kontakt med øynene eller huden.
Imidlertid er det tilsynelatende ikke nok irriterende slik at det ikke kan være en del av formuleringene av solkremer. På den annen side, å være så uoppløselig i vann, er konsentrasjonen i den ubetydelig, og presenterer seg som en solid forurensning. I denne forstand er det ukjent hvor skadelig det er for marin fauna eller jordsmonn turbiditeten som forårsaker.
Inntil det motsatte er demonstrert.
Referanser
- Morrison, r. T. og Boyd, r, n. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10. utgave.). Wiley Plus.
- Wikipedia. (2020). Dibenzylideneaceton. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2020). Dibenzylideneaceton. PubChem -database., CID = 640180. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Organiske syntesser. (2020). Dibenzalacetone. Hentet fra: Orsyn.org
- Dibenzalacetone ved aldolkondensasjon. Hentet fra: Web.Mnstate.Edu
- « Termiske forurensningskarakteristikker, konsekvenser, eksempler
- Iodometri grunnleggende, reaksjoner, generell prosedyre, bruk »

