Karbondisulfid (CS2) struktur, egenskaper, bruksområder, risikoer
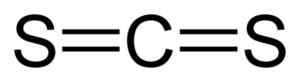
- 3556
- 195
- Thomas Karlsen
Han Karbondisulfid Det er en forbindelse dannet av foreningen av et karbonatom (C) og to svovelatomer (er). Den kjemiske formelen er CS2. Det er en fargeløs eller litt gul væske med en ubehagelig lukt på grunn av urenheter den inneholder (svovelforbindelser). Når den er ren, er lukten myk og søt, lik kloroform eller eter.
Det stammer naturlig nok fra sollysets virkning på organiske molekyler som finnes i sjøvann. I tillegg forekommer det i sumpvann og blir også utvist fra vulkaner sammen med andre gasser.
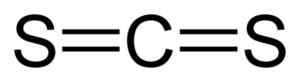 CS karbon disulfid2. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons.
CS karbon disulfid2. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons. Karbondisulfid er en flyktig væske og er også veldig brennbar, så den må holdes borte fra flammer og gnister eller enheter som kan produsere dem, inkludert elektriske pærer.
Den har muligheten til å oppløse et stort antall forbindelser, materialer og elementer, som fosfor, svovel, selen, harpiks, lakk, etc. Derfor finner den nytteverdi som et løsningsmiddel.
Det er også mellomledd i forskjellige industrielle kjemiske reaksjoner, for eksempel Rayon -produksjon eller kunstig silke.
Det må manipuleres med forsiktighet og med beskyttelsesredskaper fordi det er veldig giftig og farlig.
[TOC]
Struktur
Karbondisulfid har et karbonatom og to svovelatomer på sidene av dette.
Koblingene mellom karbonatom og svovelatomer er kovalente og doble, derfor er de veldig sterke. CS -molekylet2 Den har en lineær og symmetrisk struktur.
 Lineær struktur av karbondisulfid CS2. Svart = karbon, gul = svovel. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons.
Lineær struktur av karbondisulfid CS2. Svart = karbon, gul = svovel. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons. Nomenklatur
- Karbondisulfid
- Karbonbisulfid
- Ditiokarbonisk anhydrid
Egenskaper
Fysisk tilstand
Fargeløs til gulaktig.
Molekylær vekt
76,15 g/mol
Fusjons- eller størkningspunkt
-110,8 ° C
Kokepunkt
46,0 ºC
Flashpoint
-30 ºC (lukket koppmetode).
Selvordemperatur
90 ° C
Tetthet
Væske = 1,26 g/cm3 ved 20 ºC.
Damp = 2,67 ganger luften.
Dampene er mer enn dobbelt tung enn luft og væske er tyngre enn vann.
Damptrykk
279 mmHg ved 25 ° C.
Kan tjene deg: kaliumhypokloritt (KCLO)Dette er et høyt damptrykk.
Løselighet
Veldig lite vannløselig: 2,16 g/l a 25 ° C. Løselig i kloroform. Blandbar med etanol, metanol, eter, benzen, kloroform og karbontetraklorid.
Kjemiske egenskaper
CS2 Den fordamper lett ved romtemperatur fordi kokepunktet er veldig lavt og damptrykket er veldig høyt.
Karbondisulfid er ekstremt brennbar. Dampene hans er veldig lett betent, selv med varmen fra en elektrisk lyspære. Dette betyr at det reagerer med oksygen veldig raskt:
CS2 + 3 o2 → co2 + 2 Så2
Det at du har høyt damptrykk ved romtemperatur, gjør det farlig å være nær en flamme.
Når det er oppvarmet til nedbrytning kan lett utnytte, og avgir giftige gasser fra svoveloksider. Over 90 ° C er det slått på spontant.
Det brytes sammen når det er lagret i lang tid. Angripe kobber og legeringer. Den reagerer også med litt plast, gummi og belegg.
Reagerer under visse forhold med vann, og danner OCS karbonylsulfid, kulldioksid CO2 og hydrogen disulfid h2S:
CS2 + H2O → OCS + H2S
CS2 + 2 h2O → co2 + 2 h2S
Med alkoholer (ROH) i det alkaliske medium former Xantates (RO-CS-NNA):
CS2 + ROH + NaOH → H2Eller + ro -c (= s) -sna
Å skaffe
Karbondisulfid tilberedes kommersielt ved svovelreaksjon med kull. Prosessen utføres ved temperaturer på 750-900 ° C.
C + 2 S → CS2
I stedet for kull kan du også bruke metan eller naturgass, og til og med etan, propan og propylen har blitt brukt, i hvilket tilfelle reaksjonen skjer ved 400-700 ° C med høy ytelse.
Det kan også tilberedes ved å reagere naturgass med hydrogensulfid H2S en veldig høy temperatur.
Tilstedeværelse i naturen
CS2 Det er et naturlig produkt som er til stede i atmosfæren i veldig små mengder (spor). Det forekommer fotokjemisk i overflatevann.
Sollysets virkning på visse forbindelser som er til stede i sjøvann som cystein (en aminosyre) fører til dannelse av karbondisulfid.
 Karbondisulfid kan dannes ved virkning av solstråler på noen organiske forbindelser som er til stede i sjøvann. Forfatter: Pexels. Kilde: Pixabay.
Karbondisulfid kan dannes ved virkning av solstråler på noen organiske forbindelser som er til stede i sjøvann. Forfatter: Pexels. Kilde: Pixabay. Det frigjøres også naturlig under vulkanutbrudd og finnes i små mengder over sumper.
Kan tjene deg: benzaldehydNormalt blir vi utsatt for å puste inn veldig små proporsjoner og er til stede i noen matvarer. Det finnes også i røyk fra sigarettene.
I miljøet dekomponerer det gjennom sollys. På bakken beveger den seg gjennom den. Noen jordmikroorganismer brytes sammen.
applikasjoner
I den kjemiske industrien
Karbondisulfid er en viktig kjemisk forbindelse da den tjener til å fremstille andre kjemikalier. Kan fungere som en kjemisk mellomledd.
Det brukes også som et prosessløsningsmiddel for eksempel for å oppløse fosfor, svovel, selen, brom, jod, fett, harpiks, voks, lakk og gummi.
Tillater fremstilling av farmasøytiske produkter og ugressmidler, blant andre.
I produksjonen av Rayón og Celofán
Med CS2 Xantatos er utarbeidet som er forbindelser som brukes i produksjonen av Rayón og Celofán.
For å få kunstig silke eller rayon, er det basert på cellulose som blir behandlet med alkali og karbondisulfid CS2 og forvandles til cellulose xantate, løselig i alkali. Denne løsningen er tyktflytende og kalles derfor "viskosa".
Viskosen er gjort under press gjennom veldig små hull inne i et sur bad. Her blir cellulosen Xantate transformert igjen til cellulose som er uoppløselig og lange og lyse tråder dannes.
Tråder eller filamenter kan spunnet for å gi et materiale kjent som Rayón.
(1) Cellulose + NaOH → Alkali-celulosa
ROH + NaOH → Rona
(2) Alkali-celulose + karbondisulfid → Cellulose Xantate
Rona + s = c = s → ro -c (= s) -sna
(3) Xantat av cellulose + syre → cellulose (filamenter)
Ro -c (= s) -sna + syre → ROH
 Klær laget med Rayon, fiber hvis produksjon deltar karbondisulfid. Tobias "ta" Maier [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Klær laget med Rayon, fiber hvis produksjon deltar karbondisulfid. Tobias "ta" Maier [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Hvis cellulosen blir utfelt ved å passere Xantato gjennom et smalt spor, regenereres cellulosen i form av tynne ark som utgjør cellofanen. Dette blir myknet med glyserol og brukes som en objektbeskyttende film.
 Cellofanen er produsert ved hjelp av karbondisulfid. Forfatter: Hans Braxmeier. Kilde: Pixabay.
Cellofanen er produsert ved hjelp av karbondisulfid. Forfatter: Hans Braxmeier. Kilde: Pixabay. I produksjonen av karbontetraklorid
Karbondisulfid reagerer med klor CL2 Å gi karbontetraklorid CCL4, som er et viktig løsningsmiddel som ikke er drivstoff.
Kan tjene deg: Chlorbenzen (C6H5CL)CS2 + 3 Cl2 → CCL4 + S2Cl2
I flere applikasjoner
Karbondisulfid deltar i den kalde vulcaniseringen av gummi.
Xantatos utarbeidet med CS2 De brukes i mineralflotasjon.
Gamle bruksområder
CS2 Det er en gift for levende organismer. Tidligere ble det brukt til å ødelegge skadedyr som rotter, marmoter og maur, og helte væsken i hvert lukket rom som disse dyrene bodde (huler og hormigueros)).
Da de tette giftige damper ble brukt til dette formålet, endte de hver levende organisme som var i det avgrensede rommet.
Det ble også brukt som antihelmintisk for dyr og for å eliminere larver fra Moscardons fra magen til hester.
I landbruket ble det brukt som et insektmiddel og nematikid, for å fumigere jorden, til fumigation av barnehager, fjøs, siloer og kornmøller. Jernbanebiler, skip og lektere ble også fumigert.
 Farmer i 1904 fumigerer jorda med karbondisulfid for å bekjempe en pest av drueplanter. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu.Org/lisenser/old-lisens/fdl-1.2.html)]. Kilde: Wikimedia Commons.
Farmer i 1904 fumigerer jorda med karbondisulfid for å bekjempe en pest av drueplanter. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu.Org/lisenser/old-lisens/fdl-1.2.html)]. Kilde: Wikimedia Commons. Alle disse bruksområdene var forbudt på grunn av CS med høy brennbarhet og toksisitet2.
Risiko
CS2 Det er svært brannfarlig. Mange av reaksjonene dine kan forårsake brann eller eksplosjon. Blandingene på damper med luft er eksplosive. Når inflamming produserer irriterende eller giftige gasser.
Karbondisulfidet for avløp skal ikke helles, for i rørene er det en blanding av CS2 og luft som kan forårsake en eksplosjon hvis den er tent ved et uhell.
Dampene hans skyter spontant i kontakt med gnister eller varme overflater.
Karbondisulfid irriterer øynene, huden og slimhinnene alvorlig.
Hvis sentralnervesystemet blir inhalert eller inntatt på alvor, det kardiovaskulære systemet, øynene, nyrene og leveren. Det kan også tas opp gjennom huden som forårsaker skade.
Referanser
- ELLER.S. National Library of Medicine. (2020). Disulfid karbon. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Mopper, k. Og Kieber, D.J. (2002). Fotokjemi og sykling av karbon, svovel, nitrogen og Pospherus. I biogeokremitet av marin oppløst organisk materiale. Gjenopprettet fra Scientedirect.com.
- Meyer, f. (1977). Industriell bruk av svovel og dens kompisjoner. Disulfid karbon. I svovel, energi og misunnelse. Gjenopprettet fra Scientedirect.com.
- Pohanish, r.P. (2012). C. Disulfid karbon. I Sittigs håndbok med giftige og farlige kjemikalier og kreftfremkallende stoffer (sjette utgave). Gjenopprettet fra Scientedirect.com.
- Morrison, r.T. og Boyd, r.N. (2002). Organisk kjemi. 6. utgave. Prentice-Hall.
- WINDHOLZ, m. et al. (redaktører) (1983). Merck -indeksen. En enyclopedia av kjemikalier, medisiner og biologisk. Tiende utgave. Merck & co., Inc.
- « De 95 beste setningene av katolske helgener
- +105 katolske setninger om tro, refleksjon, bønn og håp »

