Ioniseringsenergi

- 1242
- 370
- Theodor Anders Hopland
Hva er ioniseringsenergi?
De ioniseringsenergi, Representert med symbol I, er det minimumsmengden energi som kreves for å starte det ytre elektronet til en mol atomer i en gassformig tilstand, i sin grunnleggende tilstand. Med andre ord, det er den minste mengden energi som kreves for å transformere en mol nøytrale atomer til en gassformig tilstand til en mol ioner med en positiv belastning (derav navnet).
Sett i form av en kjemisk ligning, ville ioniseringsenergi være energien som kreves for følgende prosess:
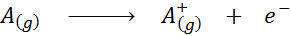
Ioniseringsenergi er et direkte mål på hvor sterkt de ytterste elektronene til et kjemisk element er koblet. Når du definerer energien i den gassformige ioniseringsprosessen, unngås bidraget eller forstyrrelsen av de intermolekylære interaksjonene som oppstår i væske og faste tilstand.
På denne måten er det sikret at ioniseringsenergi bare avhenger av atomets indre krefter og spesielt av stabiliteten til elektronene som danner valenslaget til hvert element.
Prosessen med å fjerne et elektron fra Valencia -laget er en prosess som krever energi, så det er en endotermisk prosess. Av denne grunn er ioniseringsenergier alltid positive (etter konvensjon, når energi kommer inn i et system anses som positivt).
Det er mer enn en ioniseringsenergi
Selv om definisjonen av ioniseringsenergi brukes på nøytrale atomer som blir positive ioner (det vil si kationer), kan den også påføres påfølgende fjerning av positive ionelektroner, det vil si arter som allerede allerede har mistet elektroner.
I denne forstand blir energien til å ionisere det nøytrale atomet bare den første av mange mulige ioniseringsenergier, siden det er en for hvert elektron som dreier seg om kjernen.
Kan tjene deg: Hva er elementene i bevegelsen?Med andre ord, energiene assosiert med alle følgende prosesser blir betraktet som ioniseringsenergier:
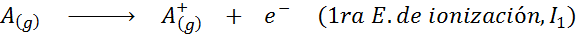
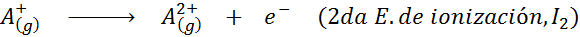
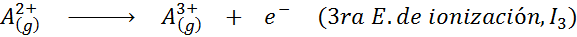
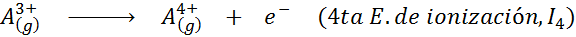
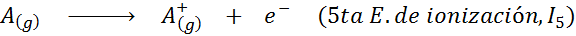
Rekkefølgen på påfølgende ioniseringsenergier
For ethvert atom av ethvert element er det oppfylt at en ioniseringsenergi alltid vil være større enn alle tidligere ioniseringsenergier. Med andre ord, påfølgende ioniseringsenergier har følgende forhold:
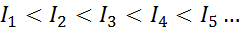
Årsaken til at dette skjer er veldig enkelt. Den første ioniseringsenergien innebærer å fjerne et elektron til et nøytralt atom. Imidlertid innebærer den andre ioniseringsenergien å ta et elektron til et atom som allerede har mistet det første.
Fraværet av et elektron etterlater en positiv nettbelastning som tiltrekker seg med mer styrke de gjenværende elektronene, så de er vanskeligere å starte. I tillegg reduserer dette fraværet også skjoldeffekten som elektronene har på de ytterste elektronene, så kjernen er i stand til å tiltrekke dem sterkere.
Resultatet er at det er vanskeligere å starte det andre elektronet enn det første, og det vil være vanskeligere å starte den tredje enn det andre, og så videre, som det kan sees i følgende ioniseringsenergibord for de første 10 elementene av bordet periodisk.
Z | Element | Først | Sekund | Tredje | Fjerdedel | Femte | Sjette |
1 | H | 1312 | |||||
2 | Han | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Være | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | ENTEN | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | Ne | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Periodisk trend med ioniseringsenergi
Ioniseringsenergi er en periodisk egenskap som øker fra venstre til høyre og nedenfra til det periodiske tabellen, som det kan sees i følgende grafikk.
Kan tjene deg: lineær utvidelse: hva er det, formel og koeffisienter, eksempel
Variasjon av jeg over en periode
Når vi beveger oss over en periode fra venstre mot høyre, kalles noe kalt den effektive kjernefysiske belastningen gradvis, noe som ikke er noe mer enn den virkelige positive belastningen som de ytterste elektronene kan "se" på grunn av skjoldet til de mest indre elektronene.
Dette betyr at kraften som kjernen er i stand til å tiltrekke seg elektronene i Valencia øker, så det blir vanskeligere å rive dem ut og den nødvendige energien (det vil si ioniseringsenergi) blir større.
Variasjon av jeg gjennom en gruppe
Når vi går ned i en gruppe, plasserer vi elektroner i økende energinivå og derfor i atombaner i økende grad langt fra kjernen. Av denne grunn avtar kraften som kjernen tiltrekker seg valenselektroner når vi går ned i en gruppe, og reduserer også ioniseringsenergien.
Hvordan bestemme ioniseringsenergi?
Ioniseringsenergi er en eksperimentelt viss mengde gjennom en serie teknikker som kalles sammen, fotoelektronspektroskopi.
Disse teknikkene er basert på et fenomen som er veldig likt den fotoelektriske effekten, der elektromagnetisk stråling er i stand til å starte elektronene til et atom, og forskjellen mellom strålingsenergi og kinetisk energi som elektron avfyres representerer ioniseringsenergien.
De forskjellige teknikkene til fotoelektronspektroskopi tillater analyse av energiene som praktisk talt ethvert elektron er koblet til kjernen, enten det er et elektron av Valencia eller et indre elektron.
Eksempler på ioniseringsenergi
Første ioniseringsenergier av edle gasser
Noble gassene har de mest stabile elektroniske konfigurasjonene av alle elementene i det periodiske bordet. Av denne grunn har de også de største ioniseringsenergiene. Den første ioniseringsenergien til hver av de edle gassene presenteres nedenfor:
-
Helium
Den første ioniseringsenergien er 2373 kJ/mol, den høyeste i hele periodiske bord.
-
Neon
Den første ioniseringsenergien er 2080 kJ/mol og er den nest høyeste.
-
Argon
Den første ioniseringsenergien er 1521 kJ/mol. Bare F, NE og han har større ioniseringsenergier.
-
Kripton
Den første ioniseringsenergien er 1350 kJ/mol. Den er ikke så høy som de andre, men den er fremdeles større enn det til nabolandet elementer.
-
Xenon
Det samme som sies om Kripton kan sies om xenon med sin første ioniseringsenergi på 1170 kJ/mol.
Kan tjene deg: ormehull: historie, teori, typer, formasjonFørste og andre ioniseringsenergier av alkaliske metaller
Alkaliske metaller har igjen den minste første ioniseringsenergi og den største andre ioniseringsenergien til alle elementer:
-
Litium
Den første ioniseringsenergien er mindre enn en fjerdedel av den av HE, men litiet har den største andre ioniseringsenergien til alle elementene, som er 7300 kJ/mol.
-
Natrium
Natriumet mister sitt første elektron veldig enkelt, siden det skaffer seg den elektroniske konfigurasjonen av NE, men for å eliminere det andre elektronet må du levere 4560KJ/mol.
-
Kalium
Den første kaliumioniseringsenergien er bare 418,7 kJ/mol, mens den andre er 3052 kJ/mol, betydelig større enn naboene.
-
Rubidium
Med en ioniseringsenergi på 403 kJ/mol, er Rubidio et av elementene med mindre ioniseringsenergi. Imidlertid er den andre 2633 kJ/mol.
-
Cesium
Den første ioniseringsenergien er bare 375 kJ/mol og den andre 2234 kJ/mol, enda lavere enn den første heliumioniseringsenergien.

