Indre energi

- 1732
- 429
- Marius Aasen
Vi forklarer hva intern energi er, dens funksjon, hvordan du beregner den og gir flere eksempler
 Diagram som viser bidrag til den interne energien til et system. Kilde: f. Zapata
Diagram som viser bidrag til den interne energien til et system. Kilde: f. Zapata Hva er indre energi?
De indre energi Fra et objekt kommer fra den tilfeldige bevegelsen som atomene og molekylene som utgjør den har. Selv når objektet er perfekt i ro, inne i det mikroskopiske nivået, beveger partiklene som komponerer det kontinuerlig uten hvile.
Siden disse partiklene beveger seg, har de kinetisk energi, som er en del av deres indre energi. Det andre bidraget til indre energi er den potensielle energien som kommer fra intermolekylære krefter, ansvarlig for å opprettholde samholdet av stoffet.
Disse intermolekylære kreftene er vanligvis av elektromagnetisk opprinnelse, men gravitasjons- og kjernefysiske krefter deltar også.
Avhengig av type bevegelse av partikler, kan kinetisk energi være:
- Translasjonell
- Vibrasjon
- Rotasjon
Temperaturen måler bare den translasjonelle kinetiske energien til partiklene. I prinsippet, ved større temperatur, vil den indre energien være større, men dette avhenger også av massen. EN eksempel Problemet tydeliggjør: Et glass med varmt vann har mindre indre energi enn en innsjø ved romtemperatur, selv om temperaturen på glasset er høyere, og det er fordi det er mer vann i innsjøen enn i glasset.
I alle fall merkes ikke den indre energien til et stoff i sikte, den avhenger ikke av bevegelsen, og det avhenger heller ikke av dens relative posisjon med hensyn til andre objekter. For eksempel er den indre energien til et glass med vann ved romtemperatur den samme hvis glasset er på et bord, eller hvis det er på gulvet.
Kan tjene deg: Ikke -koplanære vektorer: Definisjon, forhold, øvelserIntern energifunksjon
Intern energi, som vanligvis betegnes som u, er en funksjon som avhenger av de termodynamiske variablene i systemet, for eksempel temperatur T og volum V. Derfor kan det uttrykkes matematisk som:
U = u (t, v)
I virkeligheten er den absolutte verdien av den interne energien til et system ikke relevant, det som betyr noe er dens variasjon, som er betegnet med den greske bokstaven Δ (“Delta”):
ΔU = u første - ELLER endelig
Nå kan indre energi varieres hvis varmen tilsettes eller trukket ut. Å legge til varme er det mulig at systemet gjør en bestemt jobb, for eksempel et stempel i sylinderen til en motor.
Den første loven om termodynamikk
Fra den første loven om termodynamikk er det fastslått det Variasjonen av indre energi Fra et system som tilsvarer:
ΔU = q - w
Hvor det som er mengden varme som overføres til systemet og W er arbeidet som systemet gjør, i tilfelle det utfører noen. Alt måles i joules i det internasjonale systemet med enheter.
Hvis systemet ikke fungerer, brukes varmen som leveres i sin helhet for å øke den interne energien i systemet.
Følgende følger av forrige uttrykk:
- ΔU> 0 betyr at systemet øker sin interne energi
- ΔU < 0 la energía interna del sistema disminuye
- Q> 0 Systemet absorberer varme
- W> 0 Systemet fungerer.
Hvordan beregne intern energi?
Den monoatomiske ideelle gassen
I den monoatomiske ideelle gassmodellen (et enkelt atom) samhandler ikke partikler med hverandre, slik at translasjonell kinetisk energi er det eneste bidraget til indre energi eller gass. Det er et teorem, kalt Equiparition Teorem, som sier at hver frihetsgrad har en energi lik:
Det kan tjene deg: bølgediffraksjon: konsept og eksemplerHvor T er temperaturen og R er konstanten av de ideelle gassene, hvis verdi i enhetene til det internasjonale systemet er:
8.314472 J/mol ∙ k
En grad av frihet representerer muligheten for å bevege seg gjennom en viss retning i rommet. En ideell gasspartikkel kan bevege seg i de tre retningene i rommet, derfor er energien til N mol gass:
Mengde varme
Forutsatt at varmen tilsettes et system og dette fungerer ikke, brukes denne varmen bare for å øke den indre energien i systemet. Mengden varme som må være proporsjonal med massen m av systemet og temperaturendringen:
Q ∝ m⋅Δt
Proporsjonalitetskonstanten avhenger av stoffet og kalles spesifikk varme. Ringer C til denne konstante, varmen er:
Q = mc⋅ΔT
Ettersom varmen reverseres i økende indre energi:
Q = mc⋅ΔT = ΔU
ΔU tilsvarer variasjonen I indre energi.
Eksempler på indre energi
1. Temperaturvariasjoner
Endringer i temperaturen på stoffene genererer på sin side endringer i deres indre energi. Dette er for eksempel når du lager mat. Ved å varme opp mat øker agitasjonen av molekylene, kinetisk energi øker og gjør derfor sin indre energi.
2. Indre energi på to stoffer ved samme temperatur
To stoffer med samme temperatur har ikke nødvendigvis den samme indre energien, siden det avhenger av to bidrag: kinetisk energi og potensiell energi.
Hvis stoffene er på samme temperatur, kan det bekreftes at den translasjonelle kinetiske energien til den.
Kan tjene deg: Hydrostatisk trykk: Formel, beregning, eksempler, øvelser3. Termisk ekspansjon
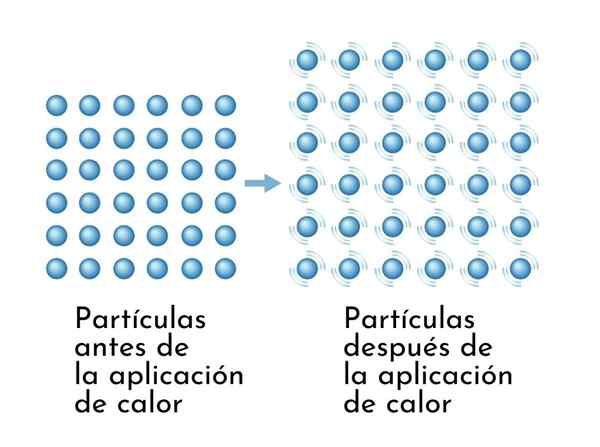 Stoffer utvides når de blir oppvarmet, siden økningen i indre energi får partiklene til å vibrere mer vidt, så dimensjonene øker
Stoffer utvides når de blir oppvarmet, siden økningen i indre energi får partiklene til å vibrere mer vidt, så dimensjonene øker En synlig konsekvens av oppvarmingsstoffer er økningen i dimensjonene deres, siden den gjennomsnittlige avstanden mellom atomene øker.
Intermolekylære krefter kan simuleres gjennom fjærer som forener atom.
4. Komprimerte gasser
Komprimerte gasser kan lagre indre energi, siden tettheten øker ved å redusere volumet og med det interaksjoner med veggene i beholderbeholderen. På denne måten er en komprimert gass i stand til å gjøre en jobb som å flytte et stempel.
5. Batterier
I et batteriets kjemiske reaksjoner oppstår i stand til å generere en elektrisk strøm så snart kretsen lukkes. Denne kjemiske potensielle energien anses som en del av systemets indre energi.
6. System som absorberer varme og fungerer
Når et system absorberer varmen, øker det den indre energien. Men hvis han samtidig gjør en jobb, kan den første loven om termodynamikk brukes til å vite hvor mye intern energi endres. For eksempel, forutsatt at et system absorberer 175 j varme og utfører en jobb som tilsvarer 62 J, er endringen i dens indre energi:
ΔU = Q - W = 175 J - 62 J = 113 J.



