Koordinert kovalent binding
- 1213
- 6
- Prof. Oskar Aas
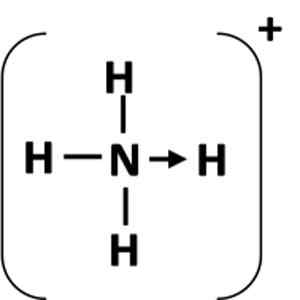
 Figur 1: Representasjon av en koordinasjonsforbindelse mellom giver (n) atom og akseptoren (h).
Figur 1: Representasjon av en koordinasjonsforbindelse mellom giver (n) atom og akseptoren (h). Hva er en koordinert kovalent lenke?
EN Koordinert kovalent binding, eller koordinasjonslenke, erEn type lenke der et av atomene leverer alle delte elektroner. Det kalles også dativ eller bipolar lenke.
I en enkel kovalent lenke leverer hvert atom et elektron til lenken. På den annen side, i en koordineringslenke, donerer et enkelt atom elektronene for å danne lenken, og kalles giveratom, mens atomet som aksepterer paret av elektroner å bli sammen, kalles akseptoratom.
En koordineringslenke er representert med en pil som starter fra de gir atomer og ender i akseptoratomet (figur 1). I noen tilfeller kan giveren være et molekyl.
I dette tilfellet kan et atom i molekylet donere paret med elektroner, som ville være basen til Lewis, mens molekylet med akseptorkapasiteten ville være Lewis -syre.
En koordineringslenke har lignende egenskaper som en enkel kovalent binding. Forbindelsene som har denne typen koblinger har vanligvis et lite smelte- og kokepunkt, med en ikke -eksisterende kulombisk interaksjon mellom atomer (i motsetning til ionisk binding) og forbindelser er veldig oppløselige i vann.
Noen eksempler på koordinerte kovalente lenker
Det vanligste eksemplet på en koordineringslenke er ammoniumionet, som dannes ved kombinasjonen av et ammoniakkmolekyl og et proton fra en syre.
Kan tjene deg: Kjemisk ligning: Deler og eksemplerI ammoniakk har nitrogenatomet et ensom elektroner etter å ha fullført oktetten. Gjort dette ensomme paret til hydrogenionet, og dermed blir nitrogenatom en giver. Hydrogenatom blir akseptoren.
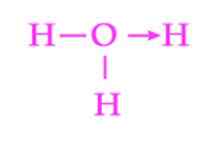 Figur 2: Representasjon av koordineringslenken til hydronio -ionen
Figur 2: Representasjon av koordineringslenken til hydronio -ionen Et annet vanlig eksempel på dativ kobling er dannelsen av hydroniumionet. Som med ammoniumionet, fungerer paret med frie elektroner i vannmolekylet som en giver til protonet som er akseptoren (figur 2).
Imidlertid må det huskes at når koordineringslenken er etablert, er alle hydrogener festet til oksygen nøyaktig likeverdige. Når et hydrogenion bryter igjen, er det ingen diskriminering mellom hvilke av hydrogenene frigjøres.
Et utmerket eksempel på en syrebasert syreaksjon, som illustrerer dannelsen av en koordinert kovalent binding er dannelsesreaksjonen til bor trifluoridaddukt med ammoniakk.
Boro Trifluoride er en forbindelse som ikke har en edelgassstruktur rundt Boro -atom. Bor har bare 3 par elektroner i valenslaget, så det sies at BF3 er mangelfull i elektroner.
Nitrogennitrogenmomentet til ammoniakk kan brukes til å overvinne den mangelen, og det dannes en forbindelse som innebærer en koordineringslenke.
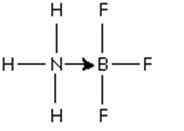 Figur 3: Tilsetning mellom bor trifluoridmolekylet og ammoniakk
Figur 3: Tilsetning mellom bor trifluoridmolekylet og ammoniakk Det par nitrogenelektroner blir gitt til orbital P tomt for bor. Her er ammoniakk basen til Lewis og BF3 er Lewis's acid.
Kan tjene deg: nitrogen -valensKoordinasjonskjemi
Det er en gren av uorganisk kjemi utelukkende dedikert til studiet av forbindelser som danner overgangsmetaller. Disse metallene binder seg til andre atomer eller molekyler gjennom koordineringslenker for å danne komplekse molekyler.
Disse molekylene er kjent som koordinasjonsforbindelser og vitenskapen som studerer dem kalles koordinasjonskjemi.
I dette tilfellet er stoffet knyttet til metallet, som vil være elektron giver, kjent som ligating og ofte til koordinasjonsforbindelser er kjent som komplekser.
Koordinasjonsforbindelser inkluderer stoffer som vitamin B12, hemoglobin og klorofyll, fargestoffer og pigmenter og katalysatorer som brukes i fremstilling av organiske stoffer.
Et eksempel på et komplekst ion ville være koboltkomplekset [CO (NH2Ch2Ch2NH2) 2ClnH3]2+ Det ville være Dichloroaminethylandiamin Cobalt (IV).
Koordinasjonskjemien oppsto fra Alfred Werners arbeid, en sveitsisk kjemiker som undersøkte forskjellige koboltkloridforbindelser (III) og ammoniakk. Etter tilsetning av saltsyre observerte Werner at ammoniakk ikke kunne elimineres fullstendig. Han foreslo da at ammoniakk skulle være nærmere knyttet til det sentrale koboltionet.
Men når vandig sølvnitrat ble tilsatt, var et av produktene som ble dannet, solid sølvklorid. Mengden sølvklorid som ble dannet var relatert til antall ammoniakkmolekyler koblet til koboltklorid (III).
For eksempel når sølvnitrat ble tilsatt til COCL3 · 6nh3, De tre kloridene ble sølvklorid.
Men når sølvnitrat ble tilsatt til COCL3 · 5NH3, Bare 2 av de 3 kloridene dannet sølvklorid. Da det var Cocl3.4nh3 Med sølvnitrat utløste et av de tre kloridene som sølvklorid.
Det kan tjene deg: Píchric Acid: Hva er, struktur, syntese, egenskaperDe resulterende observasjonene antydet dannelse av komplekse forbindelser eller koordinering. I den interne koordinasjonsfæren, som også omtales i noen tekster som den første sfæren, er ligandene direkte forent til det sentrale metallet.
I den eksterne koordinasjonsfæren, noen ganger kalt den andre sfæren, er andre ioner festet til det komplekse ionet. Werner ble tildelt Nobelprisen i 1913 for sin koordineringsteori.
Denne koordineringsteorien får overgangsmetaller til å ha to typer Valencia: det første Valencia, bestemt av oksidasjonsnummeret til metallet, og det andre Valencia kalt koordinasjonsnummer.
Oksidasjonsnummeret sier hvor mange kovalente bindinger som kan dannes i metall (eksempl4]- og [fecl4]2-).
Når det gjelder kobolt, har den koordinering nummer 6. Det er grunnen til.
Koordineringskoblingene til denne typen forbindelser har karakteristikken ved å bli farget.
De er faktisk ansvarlige for den typiske fargen assosiert med et metall (rødt jern, blå kobolt, etc.) og er viktig for spektrofotometriske øvelser av absorpsjon og atomutslipp.
Referanser
- Kjemisk binding. Gjenopprettet fra Britannica.com.
- Koordinere kovalent binding (s.F.). Gjenopprettet fra kjemi.Tutorvista.

