Dobbelt kovalent binding

- 3730
- 943
- Daniel Skuterud
Vi forklarer hva en dobbel kovalent binding er, dens egenskaper og gir flere eksempler
 Eteno eller etylenmolekyl. Det er et typisk eksempel på en dobbel kovalent binding mellom to karbonatomer
Eteno eller etylenmolekyl. Det er et typisk eksempel på en dobbel kovalent binding mellom to karbonatomer Hva er en dobbel kovalent binding?
De Dobbelt kovalente obligasjoner De er kjemiske koblinger der to atomer deler to par elektroner. Med andre ord, de er kovalente bindinger dannet av totalt fire valenselektroner som dreier seg om to atomer.
Dobbeltkoblinger er veldig vanlig i organiske forbindelser. For eksempel har alle alkener et dobbelt karbon-karbonbinding. Mange andre funksjonelle grupper som aldehyder, ketoner, karboksylsyrer og amider har også doble kovalente bindinger mellom karbon og oksygen. Andre, som imin har dobbeltkovalente bindinger c = n.
Dobbeltkoblinger har mange egenskaper som skiller dem fra andre typer kovalente bindinger som enkle koblinger og trippelkoblinger. De er forskjellige i form av molekylene som inneholder dem, i lengden og koblingskraften og andre egenskaper relatert til deres kjemiske egenskaper.
Dobbelt kovalente koblingskarakteristikker
De er dannet av 4 elektroner
Årsaken til at dobbeltbindinger er fordi de inneholder doble elektroner med en enkel kovalent binding, som dannes når to atomer deler to valenselektroner. Dette betyr at hver dobbeltbinding inneholder 4 elektroner.
De er dannet av en Sigma -kobling (σ) og en Pi (π) lenke
Av de 4 elektronene som danner en dobbeltbinding, går 2 av dem og kommer mellom ett atom og et annet, og passerer gjennom midten av de to. Dette elektronparet kalles Sigma -elektroner, siden de danner en Sigma -binding (σ).
Det andre elektronparet flyter over og under de to atomene som lager en slags sandwich. Disse elektronene kalles Pi -elektroner og danner en Pi (π) lenke.
Kan tjene deg: Chlorbenzen (C6H5CL)Sammen danner Sigma -lenken og PI -lenken den doble kovalente bindingen.
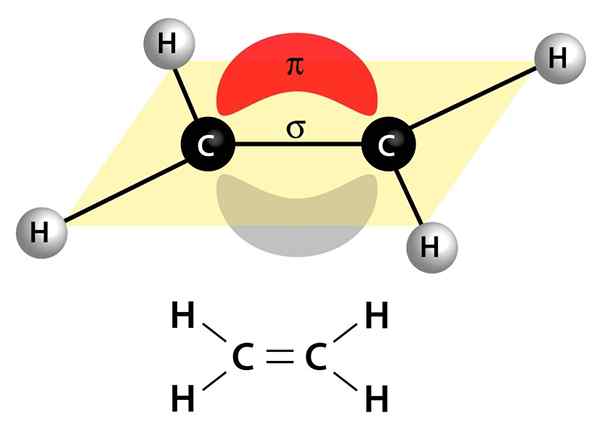 Dette bildet viser de to koblingene som utgjør en dobbeltbinding: PI -lenken som vises som en rød og grå sky som er over og under molekylet, og Sigma -lenken som er linjen som forbinder begge kjerner gjennom sentrum
Dette bildet viser de to koblingene som utgjør en dobbeltbinding: PI -lenken som vises som en rød og grå sky som er over og under molekylet, og Sigma -lenken som er linjen som forbinder begge kjerner gjennom sentrum De kan være polare eller apolare
Avhengig av elektronegativiteten til atomene som er forent ved hjelp av en dobbel kovalent binding, kan den være polar eller apolar.
For eksempel en dobbel kovalent binding C = c Det vil være en apolar kobling, siden begge atomene er de samme og har samme elektronegativitet. I stedet en dobbel kovalent binding C = O Det vil være polært, siden oksygen er mye mer elektronegativ enn karbon.
De er sterkere enn enkle lenker
Å bryte en dobbeltbinding er vanskeligere enn å bryte en enkel kobling mellom de samme to atomene. Dette er fordi, for å bryte en dobbeltbinding, både en Sigma -kobling (som er lik den enkle lenken) og en PI -kobling må brytes. Ettersom to lenker må brytes i stedet for en, er dobbeltbindingen sterkere enn den enkle.
De er svakere enn trippelkoblinger
Sammenlignet med trippelkoblingen er dobbeltbindingen svakere og lettere å bryte. Årsaken er den samme som før, bare at i dette tilfellet har dobbeltbindingen mindre koblinger enn å bryte sammenlignet med trippelkoblingen.
De er kortere enn enkle lenker
Å være sterkere lenker enn enkle lenker, er dobbeltbindinger i stand til å bringe koblede atomer nærmere enn enkle lenker enn enkle lenker. Av denne grunn, hvis en dobbel C = C-kobling sammenlignes med en enkel C-C-kobling, er den første alltid kortere enn den andre.
Kan tjene deg: natrium tiosulfat (Na2S2O3)De er lengre enn trippelkoblinger
Igjen, når trippelkoblingen er sterkere enn dobbeltkoblingen, er trippelkoblingen kortere. Dette innebærer at dobbeltkovalente bindinger er lengre enn trippel.
De er stive lenker.
Enkle kovalente bindinger er ganske fleksible og kan også rotere. På den annen side er dobbeltbindingene stive, de er ikke fleksible og kan ikke roteres, siden PI -lenken som ble nevnt ovenfor ville bli ødelagt.
De representerer umettethet
Et molekyl som har en dobbeltbinding vil ha to mindre koblede hydrogenatomer enn det kunne ha. Av denne grunn sies det at en dobbeltbinding representerer en umettethet (hver umettethet tilsvarer 2 hydrogener).
De danner flat trekant -formede molekyler
Et karbonatom som danner en dobbel kovalent binding og to andre enkle bindinger, danner alltid et flatt molekyl der de tre bindingene peker mot endene av en trekant. Denne formen kalles flat trigonal geometri.
Eksempler på doble kovalente obligasjoner
Link C = C i etylen
Etylen er et av de enkleste eksemplene på en dobbel kovalent binding, i dette tilfellet mellom to karbonatomer.
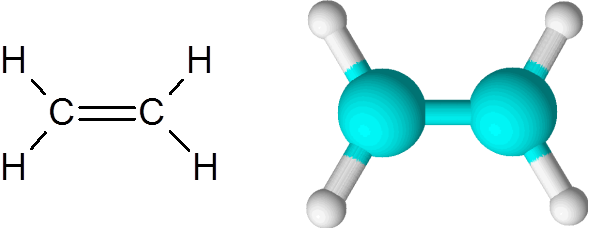 Etylenmolekyl
Etylenmolekyl Molekylet er helt flatt, og det er ikke mulig å rotere lenken i noen retning. Denne dobbeltbindingen er helt apolar, siden den kobler to like atomer.
Lenke c = o i aceton
Alle ketoner inneholder en karbonylgruppe, som består av et karbonatom og et oksygenatom forent ved hjelp av en dobbel kovalent binding.
Kan tjene deg: Hva er kjemisk kinetikk?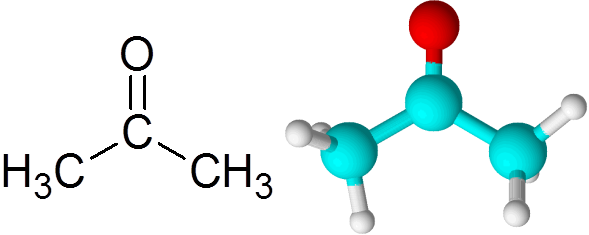 Acetonmolekyl
Acetonmolekyl Hvert atom bidrar med to manglende elektroner for å danne både PI- og Sigma -koblingen som utgjør dobbeltbindingen. De fleste av de kjemiske reaksjonene som oppstår på ketoner skyldes dobbeltbindingen C = O.
Koblingen o = eller i ozonmolekylet (eller3)
I dette tilfellet er det sentrale oksygenatomet knyttet til to andre oksygenatomer. En av de to bindingene er dannet av 4 elektroner, så den tilsvarer en dobbel kovalent binding. De tre atomene og et par elektroner uten å dele som har det sentrale oksygenatomet er alle i samme plan på skjermen som peker til hjørnene på en trekant.
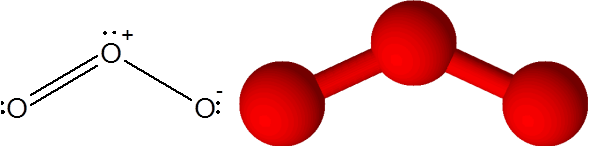 Ozonmolekyl
Ozonmolekyl Ozon har den særegenheten at dobbeltbindingen kan "hoppe" fra en av den terminale oksygen til den andre. Faktisk gjør han det veldig raskt gjennom en prosess som kalles resonans.
C = c lenker i butadieno (c4H6)
Butadieno er et eksempel på en organisk forbindelse som har to doble kovalente bindinger C = C.
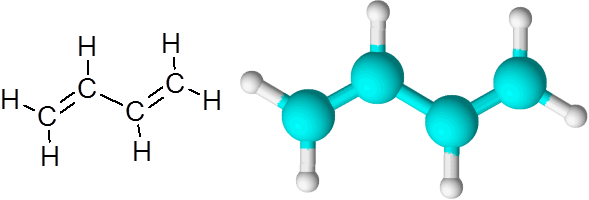 1,3-butadienmolekyl
1,3-butadienmolekyl Når dobbeltbindingene er på denne måten, atskilt med en enkelt enkel lenke, sies det at de er konjugerte dobbeltkoblinger.

