Enthalpía
- 2189
- 687
- Markus Fredriksen
Hva er entalpi?
De Enthalpía Det er en termodynamisk egenskap hvis variasjon, under konstant temperatur- og trykkforhold, bestemmer kalorienergien til et stoff eller system assosiert med en kjemisk reaksjon eller fysisk prosess. Å være en statsfunksjon, er den representert med bokstaven i kapital h, og er dens variasjon.
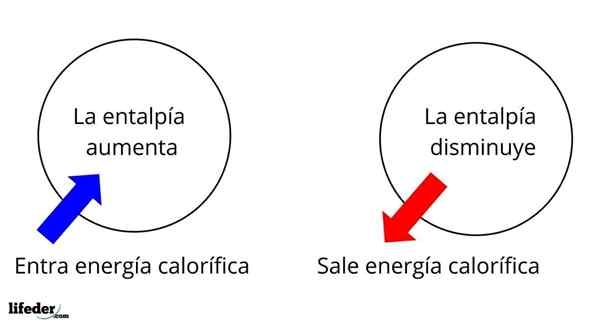
Det er en av de mest grunnleggende omfattende egenskapene å studere termokjemien til mange reaksjoner; Det vil si at vi snakker om løsgjøring eller absorpsjon av varme mellom reaksjonsmediet og omgivelsene. Dermed sier vi at en reaksjon er eksotermisk hvis dens ΔH er negativ (ΔH 0).
 Endringen av entalpi i smeltingen av isen er positiv, noe som indikerer at isen absorberer varme fra miljøet for å bevege seg til flytende tilstand, vannet
Endringen av entalpi i smeltingen av isen er positiv, noe som indikerer at isen absorberer varme fra miljøet for å bevege seg til flytende tilstand, vannet Is har for eksempel en entalpi, his, Mens vann også har sin egen entalpi, hvann. Når isen smelter, oppstår en entalpivariasjon, kalt ΔHFus eller smeltende varme (hvann-His). Vann entalpi er overlegen is og forårsaker ΔHFus For isen er positiv og har en +6 verdi.01 kJ/mol.
Enthalpy og dens variasjon uttrykkes vanligvis i Joule- eller kalorienheter. Endringen av entalpi +6.01 KJ/mol indikerer at en ismol må absorbere 6.01 KJ kalori energi eller varme for å smelte.
Hvordan beregnes entalpia?
Entalpi og dens variasjon
Entalpi i seg selv er uberegnelig, fordi det avhenger av variabler som er vanskelige å måle nøyaktig. En god sammenligning vil være å ønske å måle havets totale volum: det vil alltid være deler av det under jorden eller spredt mellom kontinentene. Derfor, og i praksis, kan H ikke bestemmes; Men ja Δh.
Kan tjene deg: kolloidFor å nå et matematisk uttrykk som tillater beregning av ΔH, må det først være igjen av den grunnleggende definisjonen av entalpi:
H = U + PV
Å være den interne energien i systemet eller det aktuelle stoffet, og PV trykktolumarbeidet som dette systemet utøver på omgivelsene som skal eksistere. Siden vi er interessert i å beregne ΔH og ingen H, har vi:
ΔH = ΔU + Δ (PV)
Hvis trykket er konstant, vil ligningen forbli:
ΔH = ΔU + PΔV
Vi vet derimot at:
ΔU = q + W
Å være q Varme og W fungerer. Erstatte oss:
ΔH = q + W + PΔV
Men i tillegg vet vi det:
W = - PΔV
Og derfor:
ΔH = q - PΔV + PΔV
ΔH = q
Det vil si at ΔH for en reaksjon eller prosess, utført under konstant trykk, vil være lik varme q generert eller absorbert.
Reaksjoner entalpi endres
Antagelsen om at trykket forblir konstant er mulig hvis reaksjonen oppstår under jordens atmosfære. For eksempel smelter isen i vinterlandskap uten å oppleve et annet press enn atmosfæren vår. På den annen side gjelder det også reaksjoner i flytende medier, eller de som ikke produserer store mengder gasser.
Disse reaksjonene absorberer eller frigjør varme q lik ΔH, som igjen, er forskjellen i entalpier mellom produkter og reaktanter:
ΔH = HProdukter - HReaktanter
Typer entalpi
Det er en vanlig praksis å snakke om ΔH og H som om de var de samme: begge kalles entalpier. Når det gjelder typene, er H imidlertid unik for hvert stoff eller system; Mens ΔH derimot er underlagt reaksjonen eller prosessens natur i seg selv.
I denne forstand har vi først positive entalpi -variasjoner (ΔH> 0) eller negativt (ΔH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Det kan tjene deg: Nitrobenzen (C6H5N2): Struktur, egenskaper, bruksområder, risikoTegnet '+' eller '-' som følger med ΔH forteller oss derfor hvis det er frigjøring eller absorpsjon av varme i en viss reaksjon eller prosess; som har sine ΔH -egenskaper, som en del av deres termokjemiske egenskaper.
Vi har uendelige typer entalpier, som kan klassifiseres i henhold til fysiske prosesser eller kjemiske reaksjoner.
Fysiske prosesser
Faseendring entalpi
Stoffer må absorbere eller frigjøre varme for å bevege seg fra en material- eller materialfase (fast, væske eller gass) til en annen. For eksempel absorberer is varme for å smelte, så entalpi for denne faseendringen tilsvarer fusjon, ΔHFus, også kalt latent varmevarme.
Entalpi av oppløsning eller blanding
Stoffer når de blir oppløst eller blandet i et løsningsmiddelmedium kan absorbere eller frigjøre varme, og dermed ha en entalpi ΔHDis eller ΔHBlande.
Kjemiske reaksjoner
Trening entalpi
Det er den tilhørende varmen, ΔHºF, til dannelse av en forbindelse, nærmere bestemt en føflekk, fra dens bestanddeler i standardbetingelser med trykk og temperatur (t = 298.15 K og P = 1 atm).
Nedbrytning entalpi
Det er den tilhørende varmen, Δhdes, til nedbrytning av en forbindelse i mindre og enkle stoffer. Det er generelt positivt, fordi det er nødvendig med varme for å bryte bindingene til molekylene.
Hydrogenering entalpi
Det er den tilhørende varmen, Δhh, Til avhengighet av et hydrogenmolekyl til en forbindelse, vanligvis et hydrokarbon.
Forbrenning entalpi
Det er varmen som frigjøres, Δhkam, Når et stoff brenner reagerer med oksygen. Det er negativt, fordi varme og lys frigjøres (brann).
Det kan tjene deg: Atommasse: Definisjon, typer, hvordan du beregner det, eksemplerEksempler på entalpier
Til slutt vil omtale av noen spesifikke eksempler på entalpier bli gjort:
Metanforbrenning
Ch4 + 22 → co2 + 2H2ENTEN
ΔH = -890.3 kJ/mol
Det vil si en mol av cho4 Når forbrenning frigjør 890.3 kJ kalorienergi.
Hydrogenering av etylen
Ch2= Ch2 + H2 → Ch3Ch3
ΔH = -136 kJ/mol
En mol etylen frigjør 136 kJ varme når hydrogen for å bli etan.
Salt i vann
Bordsalt, NaCl, oppløses i vannet for å skille NA -ionene+ og cl- av krystallinske nettverk og surround (hydrat) av vannmolekyler:
NaCl (S) → Na+(AC) + CL-(AC)
ΔH = +3.87 kJ/mol
Det vil si å løse opp salt i vann, tilsvarende for å avkjøle glasset eller beholderen. Imidlertid er den absorberte mengden varme veldig liten, så hendene våre vil bare føle en svak temperaturendring.
Kaliumkloratoppløsning i vann
På den annen side er kaliumkloratet, Kclo3, Det har en ΔhDis veldig positiv:
KCl3(S) → K+(AC) + CLO3-(AC)
ΔH = +41.38 kJ/mol
Noe som betyr at det å oppløses i vannet det absorberer veldig varmt. Og derfor vil beholderen avkjøles betydelig, og vi vil se at den omkringliggende vanndampen vil fukte sin ytre overflate.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2020). Entalpi. Hentet fra: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (28. august 2020). Enthalpy Definition in Chemistry and Physics. Gjenopprettet fra: Thoughtco.com
- Andrew Rader Studios. (2015). Energi og entalpi. Gjenopprettet fra: Physics4Kids.com
- Kidda. (2020). Enthalpy Facts for Kids. Hentet fra: Fakta.Kidda.co
- Admin. (21. desember 2010). Entalpien. Utvunnet fra: oksyorganisk kjemikalie.com
- María Estela Raffino. (11. juli 2020). Entalpia -konseptet. Gjenopprettet fra: konsept.av

