Pauling skala

- 912
- 11
- Daniel Skuterud
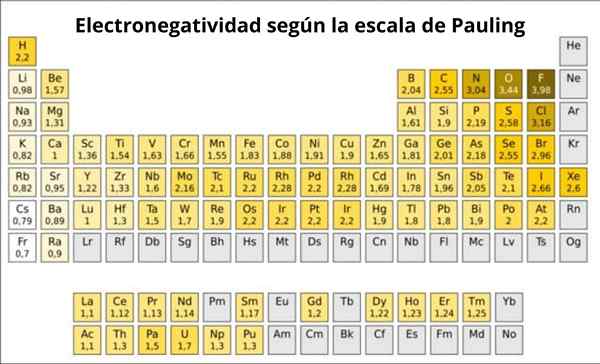 Figur 1. Pauling skala. Kilde: Wikimedia Commons.
Figur 1. Pauling skala. Kilde: Wikimedia Commons. Hva er Pauling -skalaen?
De Pauling skala Det er en vilkårlig skala som brukes i kjemi for å uttrykke Elektronegativitet av elementene. Dette er definert som tendensen til et bestemt atom til å tiltrekke elektroner når det kombineres med et annet atom.
I denne forstand har de høye elektronegativitetselementene en tendens til å få elektroner lett. Dette er ikke -metaller, mens for deres del er de mindre elektronegative elementene som metaller, det er lettere for dem å gi elektroner.
Derfor har det å kjenne elektronegativiteten til et element en ide om hvilken type lenke som er i stand til å danne seg når det kombineres med en annen. Vi vil se dette med et numerisk eksempel senere.
Med denne informasjonen kan du forutsi mange av egenskapene som en forbindelse vil ha, noe veldig nyttig i eksperimentell kjemi og for vitenskapen om materialer, der det kontinuerlig opprettes nye forbindelser.
Det er imidlertid praktisk å avklare at til tross for hvor viktig det er, er det ingen unik måte å bestemme elektronegativitet; Pauling -skalaen er bare en av de forskjellige formene som er foreslått å finne den, selv om den er en av de mest brukte.
Faktisk er Pauling's en vilkårlig skala der en numerisk verdi er tilordnet hvert element i den periodiske tabellen, som gjenspeiler dens elektronegativitet. Vi ser det i figur 1, hvor du har elektronegativiteten til hvert element, som ble tildelt av den to ganger Nobelprisen Linus Pauling (1901-1994) rundt 1939.
Elementets elektronegativitet
Pauling, ved siden av Don M. Yost, fant elektronegativitetsverdiene empirisk, gjennom eksperimentelle data som ble oppnådd ved å måle koblingsenergi.
Pauling tildelt fluoren.0. Så når fluor danner koblinger, viser det den høyeste trenden for å tiltrekke elektroner blant alle elementer.
Det kan tjene deg: Koordinasjonsnummer: Hva er, beregning, eksemplerAndre er oksygen, med 3.5 og tredje er nitrogen med 3.0. Begge er lokalisert over og til høyre for bordet.
På den annen side, i motsatt ende, er det minst elektronegative elementet cesium, hvis symbol er CS, som ligger til venstre for bordet, som Pauling tildelte nummeret 0.7.
Elektronegativitet i det periodiske tabellen
Generelt og som observert i figur 1 øker elektronegativitet - og ioniseringsenergi - fra venstre til høyre i den periodiske tabellen. Den generelle trenden indikerer også en nedgang når du går fra topp til bunn.
Derfor vil de mest elektronegative elementene ha dem i øverste høyre vinkel på tabellen: fluor, oksygen, klor, nitrogen. De minst elektronegative -eller det mest elektropositive hvis de er foretrukket -vil være til venstre: litium, natrium, kalium og de andre elementene i gruppe 1 -kolonnen til det ekstreme venstre, tilsvarende alkaliske og alkaliske metaller-.
I hver kolonne avtar elektronegativitet ved å øke atomnummeret til elementet, bortsett fra i overgangsmetaller i sentrum, som ikke følger denne trenden.
Et viktig poeng å fremheve er at elektronegativitet er relativt, det er ikke en ufravikelig egenskap for hvert element, og bare måles med hensyn til andre elementer. Det avhenger mye av oksidasjonstilstanden, slik at det samme elementet kan utvise forskjellig elektronegativitet, avhengig av type forbindelse som dannes.
Koble energiforskjell
 Figur 2. Den amerikanske kjemikeren Linus Pauling i 1955. Kilde: Wikimedia Commons.
Figur 2. Den amerikanske kjemikeren Linus Pauling i 1955. Kilde: Wikimedia Commons. I kjemi er en kobling måten atomer er sammen med, den samme eller forskjellige, for å danne molekyler. Blant atomene er krefter som holder dem sammen stabile.
Det er flere typer lenke, men to blir vurdert her:
- Kovalent, der atomer med lignende elektronegativiteter deler et par elektroner.
- Ionisk, hyppig mellom atomer med forskjellige elektronegativiteter der elektrostatisk attraksjon råder.
Anta at to elementer A E B kan danne molekyler med hverandre, betegnet AA og BB. Og de er også i stand til å bli med for å danne en AB -forbindelse, gjennom en eller annen type lenke.
Takket være deltakelse fra intermolekylære krefter, er det energi i lenken. For eksempel energien i AA -lenken er eAa, I BB -lenken er ebb og til slutt i forbindelse AB er eAB.
Hvis AB -molekylet vil bli dannet av en kovalent binding, er teoretisk koblingsenergien gjennomsnittet av energiene ogAa og eBb:
OGAB = ½ (eAa + OGBb)
Pauling beregnet eAB For flere forbindelser målte den den eksperimentelt og bestemte forskjellen mellom de to verdiene, som den kalte Δ:
Δ = | (eAB) målt - (eAB) Teoretisk | = | (EAB) målt - ½ (eAa + OGBb) |
Pauling begrunnet slik: Hvis Δ er veldig nær 0, betyr det at elektronegativitetene til begge elementene er like og koblingen som forener dem er kovalent. Men hvis Δ ikke er liten, er ikke koblingen mellom A og B ren kovalent.
Jo større den absolutte verdien av Δ, jo større er forskjellen mellom elektronegativiteten til elementene A og B, og derfor vil koblingen som Une vil være av ionisk type. Senere vil leseren finne et eksempel der det er mulig å bestemme typen lenke til en forbindelse.
Ligninger for elektronegativitet
Med utgangspunkt i at forskjellen i energi er signalet som skiller koblingens natur, gjorde Pauling mange eksperimenter som førte til at han skapte et empirisk uttrykk for relative elektronegativiteter av to elementer til E B som danner et molekyl.
Ved å betegne slik elektronegativitet som χ (gresk bokstav "chi"), definerte Pauling Δ som følger:
F2· Δ = [χ (a) - χ (b)]2
χ (a) - χ (b) = f√δ = 0.102√Δ
Kan tjene deg: Tanteo Balanse: Trinn, eksempler og øvelserMerk at Δ er en positiv mengde. Fatia f = 0.102 som vises å multiplisere kvadratroten til δ er konverteringsfaktoren mellom KJ (kilojoules) og EV (elektron-volt), begge energienheter.
Hvis i stedet kilokalororier og elektron-volt brukes, uttrykkes forskjellen til elektronegativiteter med en lignende formel, men med F = 0.208:
χ (a) - χ (b) = 0.208 vegger
Pauling begynte å tildele hydrogen verdien av 2.1, en tidligere verdi oppnådd av kjemikeren Robert Mulliken. Han valgte dette elementet som utgangspunkt fordi det danner kovalente koblinger med mange andre.
Gjennom den forrige ligningen fortsatte han å tildele verdier relatert til resten av elementene. Den innså at elektronegativiteten øker når den beveger seg fra venstre til høyre og fra topp til bunn i det periodiske tabellen, som beskrevet i forrige seksjon.
Eksempel
Nedenfor er en liste over elementer: N, J og M og deres respektive elektronegativiteter χ i henhold til Pauling -skalaen:
-N: Χ = 4.0
-J: Χ = 1.5
-OG: Χ = 0.9
-M: Χ = 1.6
Blant følgende forbindelser dannet med dem:
YJ, YN, MN og JM
Påpeke den med den største ioniske karakteren, og den hvis natur er kovalent. Årsak til svaret ditt.
Løsning
I henhold til kriteriene som er fastsatt av Pauling, vil forbindelsen med den høyeste ioniske karakteren være den med størst forskjell mellom elektronegativiteter, og derfor en større verdi på Δ. For sin del er forbindelsen med den laveste energiforskjellen den som har en kovalent binding.
Da beregner vi hvor mye Δ er verdt for hver forbindelse, som følger:
Sammensatt yj
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
Ynforbindelse
Δ = [χ (y) - χ (n)]]2 = (0.9 - 4.0)2 = 9.61
Sammensatt Mn
Δ = [χ (m) - χ (n)]2 = (1.6 - 4.0)2 = 5.76
JM -forbindelse
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
Fra ovennevnte resultater følger det at forbindelsen av ionisk karakter er YN, hvis Δ = 9.61, mens forbindelsen av kovalent karakter er JM, med Δ = 0.01.

