Absorpsjonsspekter

- 2968
- 79
- Theodor Anders Hopland
 Synlig lysspekter. Kilde: Wikimedia Commons
Synlig lysspekter. Kilde: Wikimedia Commons Hva er et absorpsjonsspekter?
EN Absorpsjonsspekter Det er produktet av samspillet mellom lys og materiale eller stoff i noen av dets fysiske tilstander. Interaksjonen inkluderer et bredt segment av området bølgelengder og energi av elektromagnetisk stråling.
Med andre ord gjenspeiler absorpsjonsspekteret at brøkdel av elektromagnetisk stråling som et visst materiale absorberer i et frekvensområde.
I denne forstand kan noen faste stoffer, væsker eller gasser absorbere fotoner med forskjellige energier eller bølgelengder, fra ultrafiolett stråling, etterfulgt av synlig lys, til stråling eller infrarødt lys, svimlende i mikrobølgebølgelengdene.
Det menneskelige øyet oppfatter bare interaksjonene mellom materie med synlig lys. Det er også i stand til å tenke på diffraksjon av hvitt lys gjennom et prisme eller et medium i dets fargerike komponenter (overlegen bilde).
Hvis lysstrålen er "fangst" etter å ha reist gjennom et materiale og analysert, ville fraværet av visse fargede bånd bli funnet. Det vil si at svarte striper vil bli observert i kontrast til bakgrunnen.
Dette er absorpsjonsspekteret, og analysen er grunnleggende i instrumentell analytisk kjemi og astronomi.
Atomabsorpsjon
I det øvre bildet vises et typisk absorpsjonsspekter av elementene eller atomer. Legg merke til at svarte striper representerer de absorberte bølgelengdene, mens de andre sendes ut. Dette betyr at tvert imot, et atomkringkastingsspekter vil se ut som et svart bånd med utsendte farger.
Men hva er de stripene? Hvordan vite om atomer absorberer eller avgir (uten å innføre fluorescens eller fosforescens)? Svarene er i de elektroniske tilstandene som er tillatt av atomer.
Kan tjene deg: Minimum formel: Hvordan få minimum formel, eksempler og øvelserElektroniske overganger og energi
Elektronene er i stand til å bevege seg bort fra kjernen, og etterlater den positivt lastet mens de reiser fra en lavere energi -orbital til en av større energi. For å gjøre dette, forklart med kvantefysikk, absorberer du fotoner med spesifikk energi for å utføre nevnte elektronisk overgang.
Derfor blir energi kvantifisert, og vil ikke absorbere medium eller tre kvarter av et foton, men frekvensverdier (v) eller betongbølgelengder (λ).
Når elektronet er spent, forblir det ikke ubegrenset i den elektroniske tilstanden med større energi. Frigjør energi i form av et foton, og atomet går tilbake til sin basale eller opprinnelige tilstand.
Avhengig av om absorberte fotoner blir registrert, vil det være et absorpsjonsspekter. Og hvis de utstedte fotonene blir registrert, vil resultatet være et emisjonsspekter.
Dette fenomenet kan observeres eksperimentelt hvis myke eller forstøvede prøver varmes opp fra et element. I astronomi, sammenligning av disse spektraene, kan sammensetningen av en stjerne være kjent, og til og med dens beliggenhet relatert til jorden.
Synlig spekter
Som det fremgår av bildet, inkluderer det synlige spekteret farger fra fiolett til rødt og alle dets nyanser med hensyn til hvor mye materialet absorberer seg (mørke nyanser).
Bølgelengdene til det røde lyset tilsvarer verdier på 650 nm og utover (til de forsvinner i infrarød stråling).
Og på venstre ende dekker fiolett og lilla toner bølgelengdeverdiene opp til 450 nm. Det synlige spekteret dekker deretter fra 400 til omtrent 700 nm.
Når λ øker, reduseres fotonfrekvensen, og derfor dens energi. Dermed har fiolett lys større energi (lavere bølgelengder) enn rødt lys (høyere bølgelengder).
Kan tjene deg: Bromin: Historie, struktur, elektronisk konfigurasjon, egenskaper, bruksområderDerfor innebærer et materiale som absorberer lilla lys elektroniske overganger av større energier.
Når materialet absorberer den fiolette fargen, vil det ha på seg en grønn gul farge, noe som betyr at elektronene utfører veldig energioverganger. Og når materialet absorberer den røde fargen, med mindre energi, vil det gjenspeile en blåaktig grønn farge.
Når et atom er veldig stabilt, presenterer det vanligvis veldig fjerne elektroniske tilstander i energi, og vil dermed trenge å absorbere fotoner med større energi for å tillate elektroniske overganger:
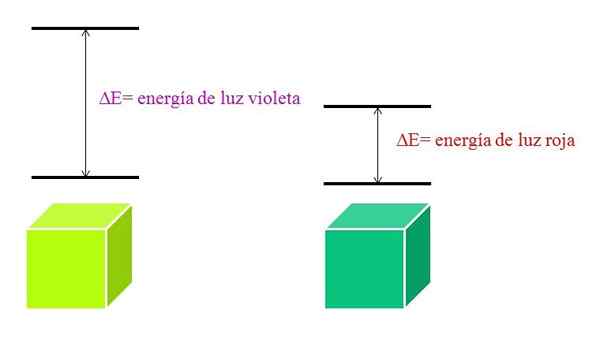 Ordning med energiene til fiolett lys og rødt lys. Kilde: Gabriel Bolívar
Ordning med energiene til fiolett lys og rødt lys. Kilde: Gabriel Bolívar Molekyler absorpsjonsspekter
Molekylene har atomer, og disse absorberer også elektromagnetisk stråling. Imidlertid er elektronene deres en del av den kjemiske bindingen, så overgangene deres er forskjellige. En av de store triumfene i molekylær orbital teori er å kunne relatere absorpsjonsspektre med den kjemiske strukturen.
Dermed har enkle, doble, trippel, konjugerte koblinger og aromatiske strukturer sine egne elektroniske tilstander, som absorberer veldig spesifikke fotoner.
Ved å ha flere atomer, i tillegg til de intermolekylære interaksjonene og vibrasjonene av koblingene deres (som også absorberer energi), har molekylene absorpsjonsspektre form av "fjell", som indikerer båndene som inkluderer bølgelengdene der elektroniske overganger.
Takket være disse spektrene kan en forbindelse karakteriseres, identifisere og til og med gjennom multivariat analyse, kvantifisere den.
Metylenblått
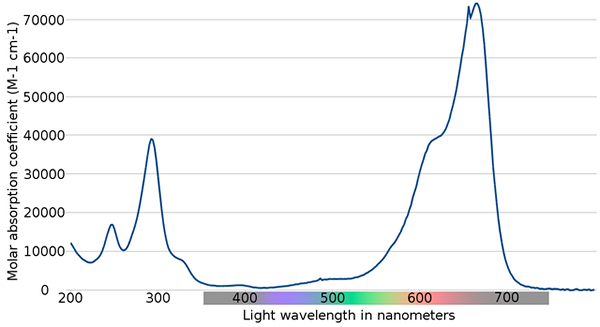 Metylenblått spektrum. Kilde: Wikimedia Commons
Metylenblått spektrum. Kilde: Wikimedia Commons I det øvre bildet vises spekteret av den blå metylenindikatoren. Som navnet påpeker, er det blått, men kan det sjekkes med absorpsjonsspekteret?
Kan tjene deg: Fysiske endringerMerk at det er bånd mellom bølgelengdene på 200 og 300 nm. Mellom 400 og 500 nm er det nesten ingen absorpsjon, det vil si at det ikke absorberer de fiolette, blå eller grønne fargene.
Imidlertid presenterer det et intenst absorpsjonsbånd etter 600 nm, og har derfor elektroniske overganger med lavt energi som absorberer røde lysfotoner.
Følgelig, og gitt de høye verdiene av molare absorbiteter, viser metylenblå en intens blå farge.
Klorofiler A og B
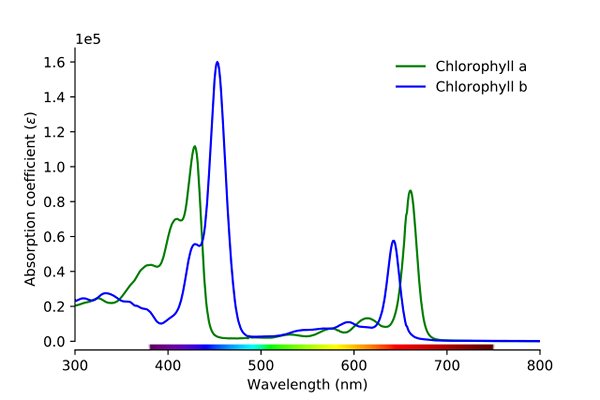 Klorofyllabsorpsjonsspekter A og B. Kilde: Wikimedia Commons
Klorofyllabsorpsjonsspekter A og B. Kilde: Wikimedia Commons Som det fremgår av bildet, tilsvarer den grønne linjen klorofyllen et absorpsjonsspekter, mens den blå linjen tilsvarer den for klorofyll b.
For det første er båndene der molare absorbiteter er høyere, i dette tilfellet de som er til venstre, mellom 400 og 500 nm. Klorofyll En intenst absorberende lilla farger, mens klorofyll B (blå linje) gjør det med blå farge.
Ved å absorbere klorofyll B rundt 460 nm (blå) gjenspeiles gul farge. På den annen side absorberer den også intenst, omtrent 650 nm, oransje lys, noe som betyr at den viser fargen blå. Hvis gult og blå er blandet, resulterer det i grønn farge.
Og til slutt absorberer klorofyll en blåaktig fiolett farge, og også et rødt lys rundt 660 nm. Derfor viser den en grønn "myk" farge etter gul.
Referanser
- Observatoire de Paris (S.F.). De forskjellige typene spektre. Hentet i gjennomsnitt4.OSPPM.fr
- Ranals University Campus (S.F.). Spektrofometri: absorpsjonsspektre og kolorimetrisk kvantifisering av biomolekyler. UCO kom seg.er

