Struktur tinn, egenskaper, innhenting, bruk

- 2968
- 266
- Mathias Aas
Han tinn Det er et metall som tilhører blokken p av det periodiske tabellen, hvis kjemiske symbol er SN, og som ligger i gruppe 14, karbonet. Til tross for at de er et mye brukt metall i hele menneskeheten siden eldgamle tider, er sannheten at det er et lite metall i jordens skorpe (2.3 ppm).
Det er et sølv, mykt, duktilt og formbart metall. Den har et atomnummer på 50, og dets dominerende tilstander eller oksidasjonstall er +2 (SN2+) og +4 (SN4+), Å være forbindelsene til tinn (ii), for eksempel SNCL2, Gode reduksjonsmidler.
 Tinn alotropes. Kilde: Zinn_9.JPG: Fra: Bruker: Tomihahndorf.Derivatarbeid: Materialscientist/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/2.0)
Tinn alotropes. Kilde: Zinn_9.JPG: Fra: Bruker: Tomihahndorf.Derivatarbeid: Materialscientist/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/2.0) Tinnet har som et symbol SN, som er en forkortelse av det latinske ordet "Stannum". Tinn er et metallbestandig mot vannangrep og luft ved romtemperatur; Men i varm luft danner tinndioksid, snam2.
Eiendommen til å være motstandsdyktig mot korrosjon, og ha et lavt smeltepunkt, har tjent til å ha mange bruksområder; slik som belegg av metalloverflater og sveising.
Tinnet har to viktigste allotropiske former: den hvite og faste ß -formen; og α, grå og normalt støvete kontekster (mer sprø). Derfor er β -formen den mest brukte i tinnapplikasjoner.
En annen viktig egenskap av tinn er dens evne til å være en del av legeringer med flere metaller, den eldste er bronse, en legering av kobber og tinn.
[TOC]
Oppdagelse
 Tinngranuler. Kilde: Nephronus, CC0, via Wikimedia Commons
Tinngranuler. Kilde: Nephronus, CC0, via Wikimedia Commons Tinn er et metall som er kjent siden eldgamle tider. Derfor er det ikke kjent hvem hans oppdager var; Og mye mindre, året og stedet for oppdagelsen.
Bronse er en legering av kobber med tinn og arsen. Det er mulig at utdypingen av denne legeringen er en konsekvens av et heldig og utilsiktet faktum, siden de første bronseobjektene - i bronsealderen - ble dannet av kobber og bare arsenspor.
Disse objektene dukket opp i det nærmeste Østen der arsen er assosiert med kobber. Men fra begynnelsen ble arsenens toksisitet bevist, og oppnådde dets erstatning2).
De eldgamle grekerne oppnådde tinn ved maritim handel og omtalte kilden til tinnet deres som "kassiteridene" som betyr 'tinnøyer'. Det er mulig at disse øyene lå i Cornuelles, British eller Spania, hvor det er store tinnavsetninger.
Det kan tjene deg: Bismuth Subsalicylate: Struktur, egenskaper, bruksområder, effekterKjemisk tinnstruktur
Når det er to alotroper: det hvite tinnet eller β-SN, og det grå tinnet eller α-SN, vil vi ha to krystallinske strukturer. Β-SN er tetragonal sentrert på kroppen (BCT), som kjennetegner formbarheten til det hvite tinnet.
I mellomtiden er strukturen til α-SN diamant; det vil si at SN -atomene er koblet til å danne tetrahedra garn, uten at det i det hele tatt er.
Tinnet presenterer også to andre alotroper under forskjellige trykkforhold (i rekkefølgen av GPA) og temperatur (over 161 ºC): σ-SN og y-SN.
Elektronisk konfigurasjon
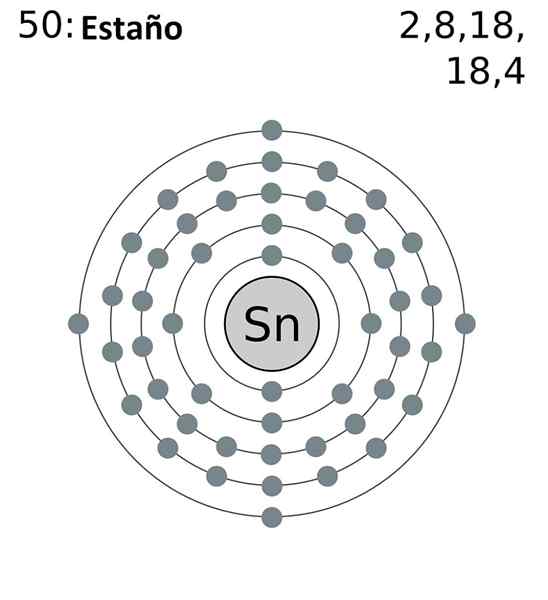
Den forkortede elektroniske konfigurasjonen er som følger:
[Kr] 4d10 5s2 5 s2
Legger til alle elektronene vi vil ha totalt 14, det samme antallet som tilsvarer gruppen din. Imidlertid er bare elektronene på 5S og 5P orbitaler de som deltar i de kjemiske reaksjonene på tinnet, siden de av 4D ikke er energisk tilgjengelige.
Tinnegenskaper
Utseende og fysiske egenskaper
Tinn er et mykt, duktil og formbart metall, som kan være kaldt og spinnende. Det lave smeltepunktet gjør det mulig å feste seg.
Når et tinnstykke er brettet, kutter det, og avgir en karakteristisk lyd kjent som "tinn shout", en konsekvens av knusing av krystallene.
Tinn har to allotropiske former: β og α. Β -formen tilsvarer et hvitt fast stoff og er ansvarlig for tinnapplikasjoner; Mens α -formen er et gråaktig pulver.
 Tinnplassering i det periodiske bordet. Kilde: Bilde av Daniel Mayer eller Greatpatton og utgitt under vilkårene i GNU FDL
Tinnplassering i det periodiske bordet. Kilde: Bilde av Daniel Mayer eller Greatpatton og utgitt under vilkårene i GNU FDL Β -formen presenteres ved temperaturer over 13.2 ºC. Når temperaturen synker 13.2 ºC, tinn endres fra β -skjema til α -skjemaet. Dette fenomenet er uønsket og unngås ved å legge andre metaller til tinn, for eksempel antimon eller vismut, som blokkerer denne endringen og forlenger dets levetid.
Tinn er den første superlederen kjent ved temperaturer under 3.72 k.
Atomnummer
femti
Molmasse
118.71 g/mol
Smeltepunkt
231.93 ºC
Kokepunkt
2602 ºC
Tetthet
Alotropo β: 7.265 g/cm3
Alotropo α: 5.769 g/cm3
Oksidasjonsstater
TIN har flere oksidasjonstilstander: -4, -3, -2, -1, 0, +1, +2, +3, +4. Imidlertid har de fleste av forbindelsene tinnet med oksidasjonstilstander +2 (SN2+) og +4 (SN4+).
Kan tjene deg: organiske forbindelserIoniseringsenergier
Først: 708.6 kJ/mol
For det andre: 1411.8 kJ/mol
Tredje: 2943.0 kJ/mol
Elektronegativitet
1.96 på Pauling -skalaen
Reaktivitet
Tinn er en metallbestandig mot luft og vannvirkning ved romtemperatur, men når den varmes opp i luften danner tinnoksid (IV), SNAM2, som er svakt sur. Det blir angrepet av syrer og alkalier, og i nærvær av oksygen kan i noen tilfeller fungere som en katalysator.
Å skaffe
 Casiterite mineral er den viktigste tinnmineralogiske kilden. Kilde: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Casiterite mineral er den viktigste tinnmineralogiske kilden. Kilde: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0) Tinnet, fra synspunktet om forekomsten, er et sjeldent metall, siden det har en overflod i jordens bark på bare 2 ppm. Casiterite mineral, et tinnoksydmineral, er den eneste tinn -kommersielle kilden.
Casiterite er et svartaktig mineral som finnes på gjørmete grunner på elvenes bredder. Tinnet trekkes ut fra casiteritten ved å varme opp til 1370 ºC med kull eller koks for å produsere dens reduksjon.
Tinn produsert er uren, så det behandles med natriumhydroksyd eller saltsyre for å solubilisere tinn. Deretter blir dette utsatt for elektrolyse, å være tinnanoden og jernkatoden. Tinnet blir avsatt på katoden, med en renhet større enn 90%.
Bruk/applikasjoner
Korrosjonsbeskyttelse
Tinn er korrosjonsbestandig metall. Den så -kallede boksen eller tinnet er en stålbeholder, dekket med et tinnlag for å unngå oksidasjon.
Boksene har blitt brukt til å lagre mat og andre stoffer, for eksempel: malerier, lakk, løsningsmidler osv. Men de blir for øyeblikket erstattet av aluminium eller plastbeholdere. Tinnbelagte rør og ventiler opprettholder vann og drikker renhet.
Legeringer
 De første bruksområdene for tinnlegeringer var å produsere containere eller redskaper som bokser og kanner i dette spiskammeret. Kilde: Butterfly Voyages - Serge Ouachée/CC av -sa (https: // creativecommons.Org/lisenser/by-SA/3.0)
De første bruksområdene for tinnlegeringer var å produsere containere eller redskaper som bokser og kanner i dette spiskammeret. Kilde: Butterfly Voyages - Serge Ouachée/CC av -sa (https: // creativecommons.Org/lisenser/by-SA/3.0) Mannen begynte å bruke bronse i mer enn 5000 år. Bronse er en legering av kobber og tinn som brukes til utdyping av verktøy, våpen, husholdningsutstyr.
På samme måte som skallet, en legering som opprinnelig var av tinn og bly, ble brukt til å lage potter, tallerkener osv. Men på grunn av ledetoksisitet er skrell for tiden produsert med tinn, antimon og koboltlegering.
Det kan tjene deg: Hypoyodous acid (HIO)Tinnlegeringen og blyet har et lite smeltepunkt, eiendom som har tillatt bruk i sveising, en teknikk som tjener til å sette sammen stykker til stede i elektriske og elektroniske kretsløp. Det er biler der tinnet er legering med jern, mens de brukes i luftfartskjøretøyer aluminium, tinn og titanlegeringer.
Circonium -legeringer, også kalt Zircaloys, brukes i atomreaktorer og har en liten mengde tinn.
 Tinnprøver. Kilde: Ondřej Mangl, Public Domain, via Wikimedia Commons
Tinnprøver. Kilde: Ondřej Mangl, Public Domain, via Wikimedia Commons Legeringen av sølv og tinn har blitt brukt i Dental Amalgams.
En krystallinsk legering med Niobio -elementet er en superleder som fungerer ved en temperatur på 18 K og opprettholder eiendommen sin i et sterkt magnetfelt.
Glass
Tinnet brukes i Pilkington -prosedyren for å produsere vindusglass. Det smeltede glasset er plassert på en smeltet tinnoverflate, og skaffer glasset en flat og glatt overflate. Denne teknikken brukes fremdeles med hell.
Tinnsalter sprayes på glasset for å oppnå et ledende kraftfor, kan bruke til å lage lyspaneler og frontrute uten frost.
Tinnforbindelser
Syndig klorid (SNCL2) Det brukes i tinn galvanisert og som et reduksjonsmiddel i fremstilling av polymerer og fargestoffer. Tinnfluorid (SNF2) Det er en aktiv ingrediens i tannpastaer.
I mellomtiden er oksidet en nyttig katalysator i visse industrielle prosesser. I tillegg brukes det som pulver til polsk stål.
Organiske tinnforbindelser brukes som biocider og soppdrepende midler, og er giftige for mennesker. Organiske tinnstabilisatorer brukes til å forhindre endringer i polyvinylklorid på grunn av eksponering for lys og varme.
Kloridet Isñico (SNCL4) brukes som parfymestabilisator og som startmateriale for andre tinnsalter.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Tinn. Hentet fra: i.Wikipedia.org
- National Center for Biotechnology Information (2020). Tinn. Pubchem Comunund sammendrag for CID 23974. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Dr. Doug Stewart. (2020). Tinnelement fakta. Gjenopprettet fra: Chemicool.com
- Redaktørene av Enyclopaedia Britannica. (2020). Tinn. Gjenopprettet fra: Britannica.com
- Bell, Terence. (26. august 2020). Egenskapene, produksjonen og anvendelsene av tinn. Gjenopprettet fra: Thoughtco.com
- Lentech b.V. (2020). Tinn. Gjenopprettet fra: Lentech.com
- Stephanie Pupas. (28. juli 2015). Fakta om tinn. Gjenopprettet fra: Livescience.com
- AIP Conference Proceedings. (9. februar 2018). Tinngjenvinning fra tinnslagg ved bruk av elektrolysemetode. gjør jeg.org/10.1063/1.5024070

