Primærstruktur av funksjoner
- 2259
- 649
- Mathias Aas
De Primærstruktur av proteiner Det er rekkefølgen som aminosyrene til polypeptidene som omfatter er ordnet. Et protein er en biopolymer dannet av a-aminosyremonomerer forenet gjennom peptidbindinger. Hvert protein har en klar sekvens av disse aminosyrene.
Proteiner utfører et stort mangfold av biologiske funksjoner, inkludert form og opprettholder integriteten til celler gjennom cytoskjelett, forsvarer kroppen av rare midler gjennom antistoffer og katalyserer de kjemiske reaksjonene til organismen gjennom enzymer.
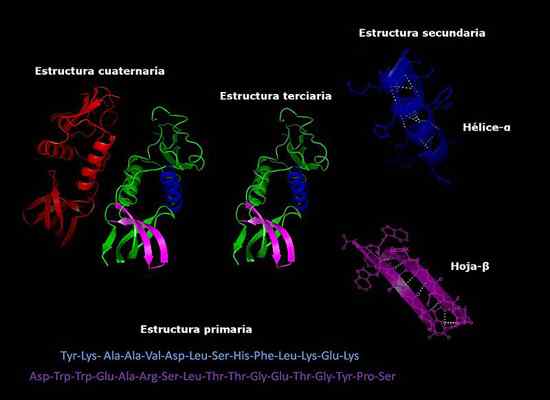
 Primære, sekundære, tertiære og kvartære strukturer av proteiner, tre -dimensjonal konformasjon. Tatt og redigert fra: Alejandro Porto [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Primære, sekundære, tertiære og kvartære strukturer av proteiner, tre -dimensjonal konformasjon. Tatt og redigert fra: Alejandro Porto [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Foreløpig er bestemmelsen av sammensetningen av proteiner og rekkefølgen aminosyrer (sekvensering) er ordnet raskere enn år siden. Denne informasjonen er satt inn i internasjonale elektroniske databaser, som kan nås via Internett (GenBank, PIR, blant andre).
[TOC]
Aminosyrer
Aminosyrer er molekyler som inneholder en aminogruppe og en karboksylsyregruppe. Når det kjede.
På grunn av denne konfigurasjonen av α-karbon er aminosyrene som dannes, kjent som a-aminosyrer, kiraer. Det er to former som er speilbilder av hverandre og som kalles enantiomerer l og d.
Alt protein av levende vesener er dannet av 20 a-aminosyrekonfigurasjon l. Sidekjedene til disse 20 aminosyrene er forskjellige og har et stort mangfold av kjemiske grupper.
I utgangspunktet kan α-aminosyrer grupperes (vilkårlig) avhengig av type sidekjeden på følgende måte.
Alifatiske aminosyrer
I denne gruppen er de inneholdt, ifølge noen forfattere, Glycine (GLI), Alanine (Wing), Valine (Val), Leucina (Leu) og isoleucine (ILE). Andre forfattere inkluderer også Metionine (MET) og Proline (Pro).
Kan tjene deg: Fosfolipider: egenskaper, struktur, funksjoner, typerAminosyrer med sidekjeder som inneholder hydroksyl eller svovel
Den inneholder serin (Ser), Cystein (Cys), Treonina (THR) og også metionin. Ifølge noen forfattere skal gruppen bare inkludere å være og thr.
Sykliske aminosyrer
Bare integrert av prolinen, som, som allerede påpekt, er inkludert av andre forfattere blant alifatiske aminosyrer.
Aromatiske aminosyrer
Fenylalanin (Phe), tyrosin (Tyr) og Triphafano (TRP).
Grunnleggende aminosyrer
Histidin (hans), lysin (Lys) og Arginina (ARG)
Syre aminosyrer og amider
Den inneholder asparaginsyrer (ASP) og glutamisk (Glu) og også aspargin (ASN) og glutamin (GLN). Noen forfattere skiller sistnevnte gruppe i to; På den ene siden av sure aminosyrer (de to første), og på den andre de som inneholder karboksylamid (de resterende to).
Peptidlenker
Aminosyrer kan bli med hverandre gjennom peptidlenker. Disse koblingene, også kalt AMIDA-koblinger, er etablert mellom a-amino-gruppen til en aminosyre og a-karboksylgruppen til en annen. Denne foreningen er dannet med tap av et vannmolekyl.
Forbundet mellom to aminosyrer resulterer i dannelse av et dipéptid, og hvis nye aminosyrer tilsettes, sekvensielt, tripide, tetrapéptider og så videre.
Polypeptidene dannet av et lite antall aminosyrer, mottar det generelle navnet på oligopeptider, og hvis antallet aminosyrer er høyt, kalles polypeptider.
Hver aminosyre som tilsettes polypeptidkjeden, frigjør et vannmolekyl. Den delen av aminosyren som har mistet H+ eller OH- under unionen, kalles resten av aminosyren.
De fleste av disse oligopeptid- og polypeptidkjedene vil i den ene enden presentere en amino-terminal (N-terminal) gruppe, og i den andre en terminal karboksyl (C-terminal). I tillegg til dette kan de inneholde mange ioniserbare grupper mellom sidekjedene til aminosyreavfallet som omfatter dem. På grunn av dette vurderes polyanfolitter.
Kan tjene deg: Flora og Fauna of Campeche: Representative arter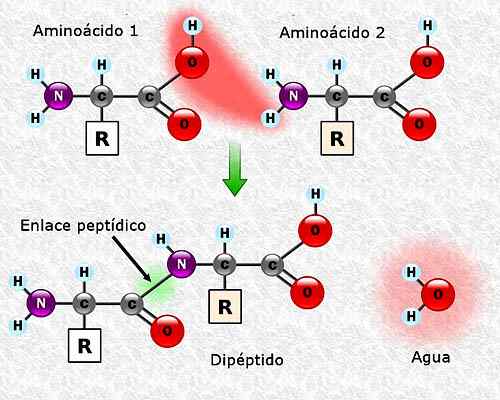 Dannelse av en peptidkobling mellom to aminosyrer. Tatt og redigert fra: Alejandro Porto [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)].
Dannelse av en peptidkobling mellom to aminosyrer. Tatt og redigert fra: Alejandro Porto [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Aminosyresekvens
Hvert protein har en viss sekvens av aminosyreavfallet. Denne ordren er det som er kjent som proteinets primære struktur.
Hvert enkelt protein av hver organisme er spesifikt for arten. Det vil si at myoglobinet til et menneske er identisk med et annet menneske, men har små forskjeller med myoglobiner til andre pattedyr.
Mengden og typene aminosyrer som et protein inneholder er like viktig som plasseringen av disse aminosyrene i polypeptidkjeden. For å kjenne proteinene, må biokjemikere først isolere og rense hvert enkelt protein, og deretter lage en analyse av aminosyreinnhold, og til slutt bestemme dets sekvens.
For å isolere og rense proteiner er det forskjellige metoder, blant dem: sentrifugering, kromatografi, gelfiltrering, dialyse og ultrafiltrering, samt bruk av proteinløselighetsegenskaper som studeres i studien.
Bestemmelsen av aminosyrene som er til stede i proteinene utføres etter tre trinn. Den første er å bryte peptidbindingene ved hydrolyse. Deretter skilles de forskjellige typer aminosyrer fra blandingen; Og til slutt blir hver av de oppnådde aminosyrer kvantifisert.
For å bestemme den primære strukturen til proteinet, kan forskjellige metoder brukes; Men for tiden er den mest brukte Edmans metode, som i utgangspunktet består av merking og separasjon av den N-terminale aminosyren fra resten av kjeden gjentatte ganger, og identifisere hver aminosyre som frigjøres individuelt.
Proteinkoding
Den primære strukturen til proteiner er kodet i organismegener. Genetisk informasjon er inneholdt i DNA, men for proteinoversettelse må først transkriberes til RNM -molekyler. Hver nukleotidtriplett (kodon) koder for en aminosyre.
Kan tjene deg: Hva er den kjemiske sammensetningen av levende vesener?Fordi det er 64 mulige kodoner og bare 20 aminosyrer brukes i konstruksjonen av proteiner, kan hver aminosyre kodes med mer enn ett kodon. Praktisk talt alle levende vesener bruker de samme kodonene for å kode de samme aminosyrene. Derfor regnes den genetiske koden som et nesten universelt språk.
I denne koden er det kodoner som brukes til å starte og også stoppe polypeptidoversettelsen. Fullføringskodonene koder ikke for aminosyre, men stopper oversettelsen til kjeden C-terminal, og er representert av UAA, UAG og UGA-tripletter.
På den annen side fungerer AUG -kodonet normalt som et startsignal og koder også metioninen.
Etter oversettelse kan proteiner lide en vis.
Referanser
- C.K. Mathews, k.OG. Van Hold & K.G. Ahern. 2002. Biochemery. 3th Utgave. Benjamin / Cummings Publishing Company, Inc.
- Murray, p. Mayes, d.C. Granner & V.W. Rodwell. nitten nittiseks. Harper's Biochemery. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & l. Stryer (SF). Biochemery. 5th Utgave. W. H. Freeman og selskap.
- J. Koolman & K.-H. Roehm (2005). Atlas of Biochemistry Color. 2Nd Utgave. Thieme.
- TIL. Lehninger (1978). Biokjemi. Omega Editions, S.TIL.
- L. Stryer (1995). Biochemery. W.H. Freeman og Company, New York.
- « Avogadro nummer historie, enheter, hvordan det beregnes, bruker
- Exonuklease -egenskaper, struktur og funksjoner »

