Kalsiumfosfat (CA3 (PO4) 2)

- 4256
- 853
- Prof. Joakim Johansen
Han Kalsiumfosfat Det er et uorganisk og tertiært salt hvis kjemiske formel er CA3(Po4)2. Formelen slår fast at sammensetningen av dette saltet er henholdsvis 3: 2 for kalsium og fosfat. Dette kan sees direkte i det nedre bildet, der CA -kationen vises2+ og anionen Po43-. For hver tredje CA2+ Det er to PO43- samspill med dem.
På den annen side refererer kalsiumfosfat til en serie salter som varierer avhengig av Ca/P -forholdet, samt graden av hydrering og pH. Det er faktisk mange typer kalsiumfosfater som eksisterer og kan syntetiseres. Imidlertid, etter brevet, henviser nomenklaturen, kalsiumfosfat bare til trisykelen, de nevnte.
 Proporsjon og ioner i trisykal fosfat. Kilde: Richard-59 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)], fra Wikimedia Commons
Proporsjon og ioner i trisykal fosfat. Kilde: Richard-59 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)], fra Wikimedia Commons Alle kalsiumfosfater, inkludert CA3(Po4)2, De er hvite faste stoffer med svake grå toner. De kan være granulære, fine, krystallinske og har partikkelstørrelser som er rundt mikrometerne; Og til og med nanopartikler av disse fosfatene er blitt fremstilt, som biokompatible materialer til beinene er designet.
Denne biokompatibiliteten skyldes at disse saltene finnes i tennene og i korte beretninger i pattedyrbenvev. For eksempel er hydroksyapatitt et krystallinsk kalsiumfosfat, som igjen interagerer med en amorf fase av samme salt.
Dette betyr at det er fosfater av amorfe og krystallinske kalsier. Av den grunn er det ikke overraskende mangfoldet og flere alternativer når du syntetiserer materialer basert på kalsiumfosfater; Materialer i hvis egenskaper hver dag er mer interesserte forskere over hele verden for å fokusere på beingjenoppretting.
Kalsiumfosfatstruktur
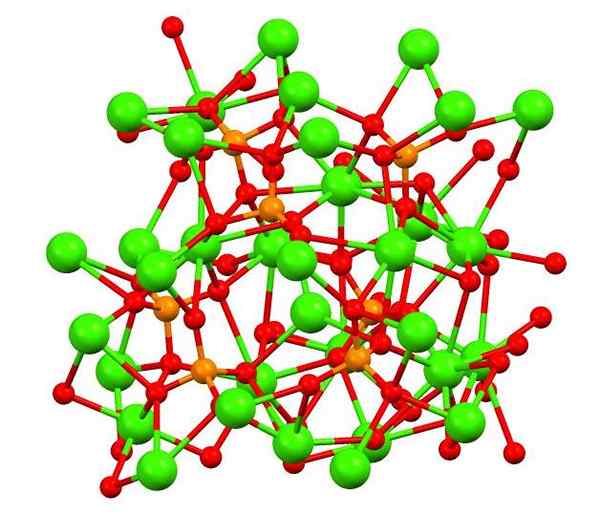 Kalsiumfosfat i Whitlockita -mineralet. Kilde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons
Kalsiumfosfat i Whitlockita -mineralet. Kilde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons Det øvre bildet viser strukturen til tribasisk kalisk fosfat i det rare Whitlockita -mineralet, som kan inneholde magnesium og jern som urenheter.
Selv om det ved første øyekast kan virke sammensatt, er det nødvendig å avklare at modellen antar kovalente interaksjoner mellom oksygenatomene til fosfater og kalsiummetallsentre.
Kan tjene deg: beryllium hydrid (Beh2)Som en representasjon er det gyldig, men interaksjonene er elektrostatiske; det vil si CA -kationer2+ føler attraksjon for PO43- (AC2+- O-po33-). Med dette i bakhodet er det forstått hvorfor på bildet kalsium (grønne kuler) er omgitt av negativt ladede oksygenatomer (røde kuler).
Når det er så mange ioner, lar ikke et symmetrisk arrangement eller mønster synlig. Ca3(Po4)2 vedtar ved lave temperaturer (t<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(Po4)2 (β-TCP, for sin forkortelse på engelsk).
Ved høye temperaturer, derimot, blir det α-CA-polymorfen3(Po4)2 (α-TCP), hvis enhetscelle tilsvarer et monoklinisk krystallinsk system. Ved enda høyere temperaturer kan også α'-CA-polymorfen dannes3(Po4)2, som er sekskantet krystallinsk struktur.
Amorf kalsiumfosfat
Krystallinske strukturer for kalsiumfosfat er blitt nevnt, noe som forventes fra et salt. Dette er imidlertid i stand til å vises.
Når dette skjer, sies det at kalsiumfosfat har en amorf struktur (AVS, Amorf kalsiumfosfat). Flere forfattere peker på denne typen strukturer som ansvarlige for de biologiske egenskapene til CA3(Po4)2 I beinvev, reparasjon og biomimetisering er mulig.
Resten av familien
Kalsiumfosfater er faktisk en familie av uorganiske forbindelser, som igjen kan samhandle med en organisk matrise.
De andre fosfatene oppnås "ganske enkelt" å endre anionene som følger med kalsium (PO43-, Hpo42-, H2Po4-, Åh-), som typen urenheter i det faste stoffet. Dermed kan opptil elleve kalsium eller flere fosfater, hver med sin egen struktur og egenskaper, oppstår naturlig eller kunstig.
Noen fosfater og deres respektive kjemiske strukturer og formler vil bli nevnt nedenfor:
-Hydrogen dihydrado kalsiumfosfat, CAHPO4∙ 2H2O: Monoklinisk.
Kan tjene deg: ammoniumoksalat-Dihydrogen monohydrert kalsiumfosfat, CA (H (H2Po4)2∙ H2O: Triclinic.
-Vannfri Dease fosfat, CA (h2Po4)2: Triclinic.
-Hydrogen oktacalcic fosfat (OCP), CA8H2(Po4)6: Triclinic. Det er en forløper i syntesen av hydroksyapatitt.
-Hydroxyapatite, CA5(Po4)3Å: sekskantet.
Fysiske og kjemiske egenskaper
Navn
-Kalsiumfosfat
-Tricalcium fosfat
-Triccal difosfat
Molekylær vekt
310,74 g/mol.
Fysisk beskrivelse
Det er et hvitt fast stoff.
Smak
Smakløs.
Smeltepunkt
1670 ºK (1391 ºC).
Løselighet
-Praktisk talt uoppløselig i vann.
-Uoppløselig i etanol.
-Løselig i saltsyre og fortynnet salpetersyre.
Tetthet
3.14 g/cm3.
Brytningsindeks
1 629
Standard treningsentalpi
4126 kcal/mol.
Lager temperatur
2-8 ºC.
Ph
6-8 i en vandig suspensjon på 50 g/l kalsiumfosfat.
Opplæring
Kalsium og hydrogennitrat ammoniumfosfat
Det er mange metoder å produsere eller danne kalsiumfosfat. En av dem består av en blanding av to salter, CA (nei3)2∙ 4H2Eller, og (nh4)2Hpo4, tidligere oppløst i henholdsvis absolutt alkohol og vann. Det ene saltet bidrar med kalsium, og det andre fosfatet.
Fra denne blandingen presipiterer ACP, som deretter gjennomgår oppvarming i en ovn ved 800 ° C og i 2 timer. Som et resultat av denne prosedyren oppnås β-CA3(Po4)2. Nøye kontrollerende temperaturer, omrøring og kontakttider kan dannelsen av nanokristale oppstå.
Å danne α-CA-polymorfen3(Po4)2 Det er nødvendig å varme opp fosfatet over 1000 ° C. Denne oppvarmingen utføres i nærvær av andre metallioner, som stabiliserer denne polymorfen nok til at den kan brukes ved romtemperatur; det vil si at det forblir i en stabil måltilstand.
Kalsiumhydroksyd og fosforsyre
Kalsiumfosfat kan også dannes ved å blande kalsiumhydroksyd og fosforsyreoppløsninger, forekommende syre-base-nøytralisering. Etter en halv dag med modning i moren ånder, og deres forfalte filtrering, vasking, tørking og siktet, oppnås et granulært støv av amorf fosfat, ACP oppnås.
Dette ACP -reaksjonsproduktet av høye temperaturer, transformerer i henhold til følgende kjemiske ligninger:
2ca9(HPO4) (Po4)5(Å) => 2ca9(S2ENTEN7)0,5(Po4)5(Å) + H2O (a t = 446,60 ° C)
2ca9(S2ENTEN7)0,5(Po4)5(Å) => 3ca3(Po4)2 + 0,5H2O (a t = 748,56 ° C)
Kan tjene deg: selen: historie, egenskaper, struktur, innhenting, brukPå denne måten oppnås β-CA3(Po4)2, Din vanligste og stabile polymorf.
applikasjoner
I beinvev
Ca3(Po4)2 Det er den viktigste uorganiske bestanddelen av bein aske. Det er en komponent av beinerstatningstransplantasjoner, dette blir forklart med dens kjemiske likhet med mineralene som er til stede i beinet.
Biomaterialer av kalsiumfosfat brukes til å korrigere beindefekter og for å dekke metallproteser. Kalsiumfosfat blir avsatt på dem, isolerer dem fra miljøet og bremser korrosjonsprosessen i titanet.
Bioceramic sement
Kalsiumfosfatsement (CPC) er en annen bioceramic som brukes i beinvevsreparasjon. Det blir utdypet ved å blande støvet fra forskjellige typer kalsiumfosfater med vann, og danne en pasta. Pasta kan injiseres eller justeres til beindefekten eller hulrommet.
Sementene blir støpt, gradvis reabsorberes og erstattes av det nydannede beinet.
Leger
-Ca3(Po4)2 Det er et grunnleggende salt, så det brukes som en antacida for å nøytralisere overflødig magesyrhet og øke pH. I tannpasta leverer en kilde til kalsium og fosfat for å lette prosessen med remineralisering av tenner og beinhemostase.
-Det brukes også som et ernæringstilskudd, selv om den mest økonomiske måten å levere kalsium er ved å bruke karbonatet og sitratet.
-Kalsiumfosfat kan brukes i behandlingen av tethany, latent hypokalsemi og vedlikeholdsbehandling. I tillegg er det nyttig i kalsiumtilskudd under graviditet og amming.
-Det brukes til behandling av forurensning med radioaktiv Isotopos-radio (RA-226) og Strontium (SR-90). Kalsiumfosfat blokkerer absorpsjonen av radioaktive isotopoer i fordøyelseskanalen, og begrenser dermed skaden forårsaket av dem.
Andre
-Kalsiumfosfat brukes som fôr for fugler. I tillegg brukes det i tannpastaer i kontrollen av tartaren.
-Det brukes som et anti -gomerant middel, for eksempel for å forhindre at bordsalt blir kompakt.
-Det fungerer som et blekemiddel for melet. I mellomtiden forhindrer i cochino smør en uønsket farge og forbedrer tilstanden til steking.
Referanser
- Kalsiumfosfat. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Kalsiumfosfat. Science Direct. Hentet fra: Scientedirect.com

