Magnesiumfosfat (MG3 (PO4) 2)
- 4823
- 793
- Oliver Christiansen
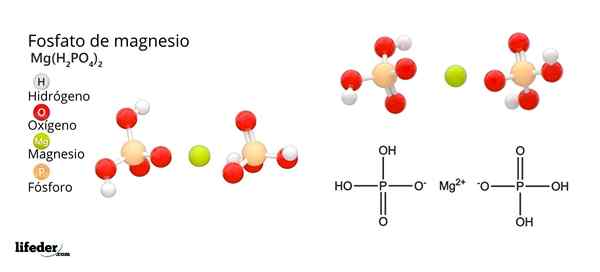
 Struktur og formel av magnesiumfosfat
Struktur og formel av magnesiumfosfat Hva er magnesiumfosfat?
Han Magnesiumfosfat Det er et begrep som brukes til å referere til en familie av uorganiske forbindelser dannet av magnesium, alkalisk metall og fosfatoksoanion. Det enkleste magnesiumfosfatet har en MG kjemisk formel3(Po4)2. Formelen indikerer at for hver annen anion PO43- Det er tre MG -kationer2+ samspill med disse.
Disse forbindelsene kan også beskrives som magnesiumsalter avledet fra ortofosfahinsyre (H3Po4). Med andre ord, magnesium er "samlet" mellom fosfatanioner, uavhengig av dens uorganiske eller organiske presentasjon (MGO, MG (nei3)2, Mgcl2, MG (OH)2, etc.).
På grunn av disse grunnene kan magnesiumfosfater bli funnet som flere mineraler. Noen av disse er: catteite -mg3(Po4)2 · 22H2O-, Struvita -(NH4) MGPO4· 6H2Eller, hvis mikrokrystaller er representert i overlegen bilde-, Holtedalita -MG2(Po4) (Å) - og bobierrit -mg3(Po4)2· 8H2ENTEN-.
Når det. Imidlertid er magnesiumfosfater preget av å utvise et rikt strukturelt kjemikalie, noe som betyr at deres ioner tar i bruk mange krystallinske arrangementer.
Magnesiumfosfatformer og nøytraliteten til belastningen deres
Magnesiumfosfater stammer fra erstatning av H -protoner3Po4. Når ortofosforsyre mister et proton, forblir det som fosfatdihydrogenion2Po4-.
Hvordan nøytralisere den negative belastningen for å forårsake magnesiumsalt? Ja Mg2+ Redegjør for to positive kostnader, trenger deretter to H2Po4-. Dermed oppnås magnesium diácido fosfat, Mg (H2Po4)2.
Når syren mister to protoner, gjenstår hydrogenfosfationionet, HPO42-. Nå hvordan man nøytraliserer disse to negative ladningene? Som MG2+ Du trenger bare to negative ladninger for å nøytralisere, samhandle med et enkelt HPO -ion42-. På denne måten oppnås magnesiumsyrefosfat: MGHPO4.
Kan tjene deg: magnesiumoksyd: struktur, egenskaper, nomenklatur, brukTil slutt, når alle protoner går tapt, gjenstår fosfatanionen43-. Dette krever tre MG -kationer2+ og fra et annet fosfat å samles i et krystallinsk fast stoff. Matematisk ligning 2 (-3) + 3 (+2) = 0 hjelper til med å forstå disse støkiometriske proporsjonene for magnesium og fosfat.
Som et resultat av disse interaksjonene produseres tribasisk magnesiumfosfat: MG3(Po4)2. Hvorfor er tribasisk? Fordi han er i stand til å godta tre Hs tilsvarende+ Å danne h igjen3Po4:
Po43-(AC) + 3H+(AC) H3Po4(AC)
Magnesiumfosfater med andre kationer
Kompensasjon av negative ladninger kan også oppnås med deltakelse fra andre positive arter.
For eksempel å nøytralisere PO43-, K -ionene+, Na+, RB+, NH4+, etc., De kan også gå inn i og danne sammensatt (x) MGPO4. Hvis x er lik NH4+, Det vannfrie struvittiske mineralet dannes, (NH4) MGPO4.
Gi. Takket være dette kan mange magnesiumfosfatkrystaller syntetiseres (Na3RBMG7(Po4)6, For eksempel).
Struktur

Det overordnede bildet illustrerer interaksjonene mellom MG -ioner2+ og po43- som definerer den krystallinske strukturen. Imidlertid er det bare et bilde som heller viser den tetrahedrale geometrien til fosfater. Deretter innebærer den krystallinske strukturen fosfat- og magnesiumfærer tetrahedra.
I tilfelle av MG3(Po4)2 vannfri, ionene vedtar en rhombohedral struktur, der mg2+ er koordinert med seks atomer av O.
Ovennevnte er illustrert i det nedre bildet, med dimensjonen at de blå kulene er kobolt, bare endrer dem for de grønne sfærene i magnesium:
Kan tjene deg: Ikke -varroelle legeringer: Struktur, egenskaper, bruksområder, eksempler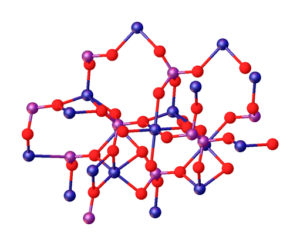
Akkurat i sentrum av strukturen kan octaedro dannet av de seks røde kulene rundt den blålige sfæren være lokalisert.
Disse krystallinske strukturene er også i stand til å akseptere vannmolekyler, og danner magnesiumfosfathydrater.
Dette er fordi de danner hydrogenbroer med fosfationer (HOH-O-PO33-). I tillegg er hvert fosfation i stand til å akseptere opptil fire hydrogenbroer; det vil si fire vannmolekyler.
Som MG3(Po4)2 Den har to fosfater, kan akseptere åtte vannmolekyler (som skjer med Bobierrite -mineralet). På sin side kan disse vannmolekylene danne hydrogenbroer med andre eller samhandle med de positive MG -sentrene2+.
Egenskaper
Det er et hvitt fast stoff som danner krystallinske rombiske plater. Det har heller ingen lukt og smak.
Den er veldig uoppløselig i vann, selv når det er varmt, på grunn av sin store krystallinske nettverksenergi; Dette er produktet av de sterke elektrostatiske interaksjonene mellom Mg allsidige ioner2+ og po43-.
Det vil si at når ionene er allsidige og deres ioniske radioer ikke varierer mye i størrelse, viser den faste motstanden mot oppløsningen.
Smelter til 1184 ºC, noe som også er en indikasjon på de sterke elektrostatiske interaksjonene. Disse egenskapene varierer avhengig av hvor mange molekyler av absorberende vann, og hvis fosfat er i noen av dets protonerte former (HPO42- eller h2Po4-).
Bruk/applikasjoner
Avføringsmiddel
Det har blitt brukt som avføringsmiddel for tilstand av forstoppelse og gastrisk surhet. Imidlertid har dens skadelige bivirkninger - manifestert av generering av diaré og oppkast - begrenset bruken av dem. I tillegg vil det sannsynligvis gi skade på mage -tarmkanalen.
Kan tjene deg: molekylært oksygen: struktur, egenskaper, brukBeinreparasjon
Bruken av magnesiumfosfat i reparasjon av beinvev blir for øyeblikket undersøkt, og undersøker anvendelsen av MG (h2Po4)2 som sement.
Denne formen for magnesiumfosfat oppfyller kravene til dette: det er biologisk nedbrytbart og histokompatibel. I tillegg anbefales bruken i regenerering av beinvev for sin motstand og raske omgivelser.
Materiale for ortopedi
Bruken av amorft magnesiumfosfat (AMP) blir evaluert som biologisk nedbrytbar og ikke -eksoterm ortopedisk sement. For å generere denne sementen, blandes forsterkerpulveret med polyvinylalkohol for å danne en kitt.
I levende vesener
Hovedfunksjonen til magnesiumfosfat er å tjene som et MG -bidrag til levende vesener. Dette elementet griper inn i en rekke enzymatiske reaksjoner som katalysator eller mellomledd, og er avgjørende for livet.
En Mg -mangel hos mennesker er assosiert med følgende effekter: reduksjon i CA -nivåer, hjertesvikt, oppbevaring av Na, reduserte K -nivåer, arytmier, vedvarende muskelkontraksjoner, oppkast, kvalme, lave sirkulerende nivåer av paratyreoideahormon og mage og menstruasjon, blant andre.
Referanser
- Mineral Data Publishing. (2001-2005). Bobierrite. Gjenopprettet fra håndbok av mineralogi.org
- Sahar Mousa. (2010). Studie om syntese av magnesiumfosfatmaterialer. Fosforforskningsbulletin Vol. 24, s. 16-21.
- Wikipedia. (2018). Magnesiumfosfat tribasic. Innhentet fra.Wikipedia.org
- Pubchem. (2018). Magnesiumfosfat vannfri. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov
- Barbie, e., Lin, f., Goel, v.K. Og Bhaduri, S. (2016) Evaluering av amorf magnesiumfosfat (AMP) -basert ikke-eksoterm ortopedisk sement. Biomedisinsk matte. Volum 11 (5): 055010.
- Yu, og., Yu, kap. Og Dai, h. (2016). Forberedelse av nedbrytende magnesiumbone sement. Regenerative biomaterialer. Volum 4 (1): 231

