Metallisk karakter
- 2298
- 402
- Prof. Joakim Johansen
Hva er den metalliske karakteren?
Han Metallisk karakter av elementene Den periodiske tabellen refererer til alle de variable, kjemiske og fysiske, som definerer metaller eller skiller dem fra andre naturstoffer. De er vanligvis lyse, tette, harde, høye termiske og elektriske, formbare og duktile konduktiviteter.
Imidlertid viser ikke alle metaller slike egenskaper; For eksempel når det gjelder kvikksølv, er dette en lys svart væske. Disse variablene avhenger også av landets trykk og temperaturforhold. For eksempel kan tilsynelatende ikke -metallisk hydrogen oppføre seg fysisk som et metall under ekstreme forhold.
Disse forholdene kan være: under avgrenset trykk eller veldig kalde temperaturer rundt det absolutte null. For å definere om et element er metallisk eller ikke, er det nødvendig å vurdere skjulte mønstre i observatørens øyne: atommønstre.
Disse diskriminerer mer presisjon og pålitelighet hva er metallelementene, og til og med hvilket element som er mer metallisk enn et annet.
På denne måten hviler den sanne metalliske karakteren til en gullmynt mer på egenskapene til atomene enn de som er bestemt av dens gyldne masse, selv begge er nært beslektede.
Hvilken av myntene er mer metallisk: en av gull, en av kobber eller en platina? Svaret er platina, og forklaringen ligger i atomene.
Hvordan varierer den metalliske karakteren til elementene i den periodiske tabellen?
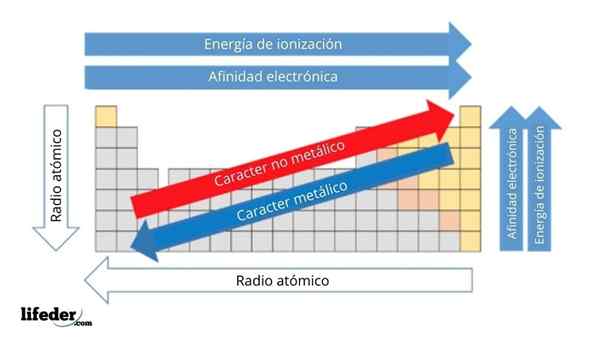
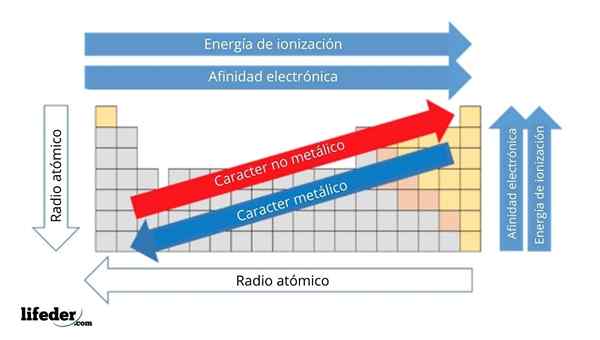
I det øvre bildet har du de periodiske egenskapene til elementene. Radene tilsvarer periodene og kolonnene til gruppene.
Den metalliske karakteren avtar fra venstre til høyre for den periodiske tabellen, og øker i motsatt retning. På samme måte øker den metalliske karakteren fra topp til bunn og avtar når perioder blir reist til gruppeleder.
Det kan tjene deg: Baser: Karakteristikker og eksemplerPå denne måten har elementene som er i nærheten av retningen som pilen peker, større metallisk karakter enn de som ligger i motsatt retning (de gule blokkene).
I tillegg tilsvarer de andre pilene andre periodiske egenskaper, som definerer i hvilken forstand de øker eller avtar når elementet er "metallisk". For eksempel er elementene i de gule blokkene, selv om de har lav metallisk karakter, deres elektroniske affinitet og ioniseringsenergi høy.
Når det gjelder atomradioer, jo større, jo mer metallisk er elementet; Dette indikeres av den blå pilen.
Egenskaper til metalliske elementer
I den periodiske tabellen observeres det at metaller har store atomradioer, lave ioniseringsenergier, lave elektroniske tilhørigheter og lave elektronegativiteter. Hvordan du husker alle disse egenskapene?
Punktet som de flyter er reaktiviteten (elektropositiviteten) som definerer metaller, som oksiderer; det vil si at de mister elektronene lett.
Når de mister elektroner, danner metaller kationer (m+). Derfor danner elementene med den høyeste metalliske karakterkationene lettere enn de med lavere metallisk karakter.
Et eksempel på det ovennevnte er å ta hensyn til reaktiviteten til elementene i gruppe 2, de alkalinaloterrous metaller. Beryllium er mindre metallisk enn magnesium, og dette er igjen mindre metallisk enn kalsium.
Så videre til å nå metallbario, den mest reaktive av gruppen (etter radius, radioaktivt element).
Hvordan påvirker atomradiusen på reaktiviteten til metaller?
Når atomradius øker, er Valencias elektroner lenger borte fra kjernen, så de blir beholdt med mindre kraft i atomet.
Kan tjene deg: natriumhydroksid (NaOH): struktur, egenskaper, bruksområder, synteseImidlertid, hvis en periode blir reist til høyre side av det periodiske tabellen, tilfører kjernen protoner til kroppen, nå mer positiv, noe som tiltrekker valenselektroner sterkere, og reduserer størrelsen på atomradius. Dette resulterer i en reduksjon i metallisk karakter.
Dermed har et veldig lite atom og med en veldig positiv kjerne en tendens til å få elektroner i stedet for å miste dem (ikke -metalliske elementer), og de som både kan vinne og miste elektroner, anses som metalloider. Bor, silisium, Germanio og Arsen er noen av disse metalloidene.
På den annen side øker også atomradius hvis det er ny energitilgjengelighet for andre orbitaler, som oppstår når du synker ned i en gruppe.
Av denne grunn, når de synker i det periodiske tabellen, blir radioene klumpete og kjernen blir ikke i stand til å forhindre at andre arter snapper elektronene fra deres ytre lag.
I laboratoriet, med et sterkt oksidasjonsmiddel -lignende fortynnet salpetersyre (HNO3)- Metallaktiviteter i møte med oksidasjon kan studeres.
Tilsvarende er dannelsesprosessene til metallhalogenidene deres (for eksempel NaCl) også demonstrative eksperimenter av denne reaktiviteten.
Element av større metallisk karakter
 Cesium
Cesium Retningen til den blå pilen i bildet av det periodiske bordet fører til Francio- og Cesio -elementene. Francio er mer metallisk enn cesium, men i motsetning til sistnevnte er Francio kunstig og radioaktiv. Av denne grunn opptar cesium stedet for det naturlige elementet med større metallisk karakter.
Kan tjene deg: jernoksidEn av de mest kjente (og eksplosive) kjente reaksjonene er faktisk den som oppstår når et stykke (eller dråper) av cesium kommer i kontakt med vann.
Den høye reaktiviteten til cesium, også oversatt til dannelsen av mye mer stabile forbindelser, er ansvarlig for den plutselige frigjøringen av energi:
2CS (S) + 2H2O → 2CSOH (aq) + H2(g)
Den kjemiske ligningen gjør det mulig å se oksidasjon av cesium og reduksjon av vannhydrogen til gassformig hydrogen.
Element av lavere metallisk karakter
 3D fluormodell
3D fluormodell I motsatt diagonal, i øverste høyre hjørne av det periodiske tabellen, fluor (f2, Overlegen bilde) leder listen over ikke -metalliske elementer. Fordi? Fordi det er elementet i den mest elektronegative naturen og den med den laveste ioniseringsenergien.
Med andre ord reagerer den med alle elementene i den periodiske tabellen for å danne ion F- og ikke f+.
Fluor er svært usannsynlig å miste elektroner i en viss kjemisk reaksjon, ganske i strid med metaller. Det er av denne grunn at det er elementet med lavere metallkarakter.
Referanser
- Lumen, kjemi for ikke-major. Metallisk og ikke -metalllisk karakter. Gjenopprettet fra kurs.Lumenarning.com
- Kjemioppdrag. (2018). Elektropostivitet eller metallisk karakter. Gjenopprettet fra kjemisk tildeling.com
- Juan Ramos. Komplett liste over metaller og ikke -metaller. Gjenopprettet fra vitenskaper.com
- Anne Marie Helmestine, pH.D. Metalliske karakteregenskaper og trender. Gjenopprettet fra Thoughtco.com

