Natriumfosfatstruktur, egenskaper, syntese, bruk

- 974
- 161
- Dr. Andreas Hopland
Han Natriumfosfat Det er et uorganisk salt hvis kjemiske formel er NA3Po4. Den mottar også trisodiøse fosfatnavn (TSP for forkortelsen på engelsk: Trisodiumfosfat), eller tribasisk natriumfosfat, fordi det helt mangler evnen til å donere hydrogenioner h+.
Når du henviser til det på en flertall måte, natriumfosfater, er det snakk om hele salmen av salter, hydrert eller ikke, stammer fra elektrostatiske interaksjoner mellom Na+ og PO43-. Noen av disse saltene består til og med av natriumpyrofosfater, eller uorganiske polymerer som har PO43- som monomer.
 Klokkeglass med natriumfosfatkrystaller. Kilde: Ondřej Mangl [Public Domain]
Klokkeglass med natriumfosfatkrystaller. Kilde: Ondřej Mangl [Public Domain] Det er grunnen til at med mindre en spesifikasjon blir gjort, vil den alltid referere til NA3Po4, Og ikke til nah2Po4, na2Hpo4, Na4P2ENTEN7 Ikke noe annet salt.
Det øvre bildet viser utseendet til natriumfosfat, som ser hvite krystaller som ligner på vanlig salt eller bord, eller kjøpt som et hvitt amorf -utseende pulver. Deretter en3Po4 er i stand til å danne flere hydrater, være NA3Po4· 12H2Eller den som markedsføres mest.
Den finner hovedsakelig bruk i matindustrien, i vaskemidler, sportstilskudd og fungerer som hyperosmotisk avføringsmiddel.
[TOC]
Kjemisk struktur
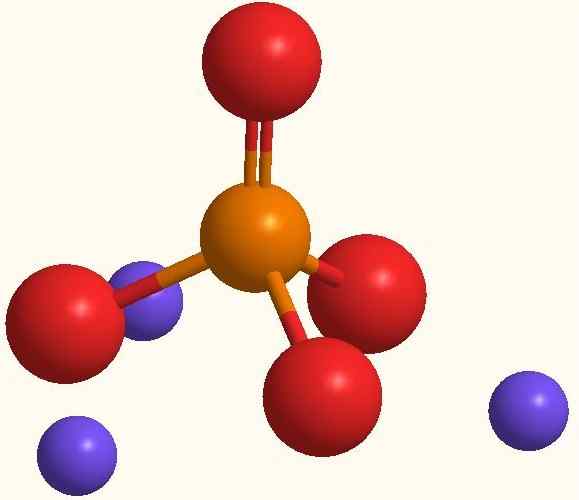 Hovedioner av natriumfosfat. Kilde: Smolamj via Wikipedia.
Hovedioner av natriumfosfat. Kilde: Smolamj via Wikipedia. Den samme na -formelen3Po4 indikerer det for hver anion PO43- Det er tre na -kationer+. Disse ionene kan observeres i det overordnede bildet. Merk at PO43- Den har tetraedrisk geometri, med sine oksygenatomer som bærer en resonans negativ belastning, som tiltrekker seg NA+ av miljøet.
Også NA -formelen3Po4 Han påpeker at det er vannfri salt, så det er ingen vannmolekyler inkludert i krystaller. Elektrostatiske attraksjoner mellom NA+ og PO43- De ender opp med å definere en trigonal hvit krystall. Dens ioniske kobling er slik at NA3Po4 Den har et fusjonspunkt på 1583 ºC, betydelig høyere enn for flere salter.
Kan tjene deg: Cannizzaro -reaksjon: Kjennetegn, mekanismer, eksemplerBegge Na+ Som PO43- De er ioner som kan hydreres i høy grad, uten å påvirke krystallens stabilitet negativt.
Det er av denne grunn at hydrater også kan krystallisere; Imidlertid er smeltepunktene lavere enn vannfritt salt, ettersom intermolekylære hydrogenbroer i vannet skiller ionene og svekker interaksjonene. I NA3Po4· 12H2Eller for eksempel smeltepunktet er 73,4 ºC, mye mindre enn NA3Po4.
Egenskaper
Fysisk utseende
Det kan oppstå som definerte hvite krystaller eller som støv eller granuler i samme farge. Alle de fysiske størrelsene som er uttrykt nedenfor, henviser bare til det naive saltet3Po4.
Smeltepunkt
1583 ºC
Kokepunkt
100 ºC
Vannløselighet
14,5 g/100 ml ved 25 ° C, så det regnes som et ganske løselig vannfosfat. Imidlertid er det uoppløselig i organiske løsningsmidler som etanol og karbondisulfid.
Tetthet
2.536 g/cm3 ved 17,5 ºC.
Stabilitet
Det er et hygroskopisk fast stoff. Derfor må den lagres på en slik måte at den ikke kan utsettes for fuktighet.
Ph
Det er et sterkt alkalisk salt. For eksempel har en vandig løsning av den 0,1% allerede pH 11,5. Denne egenskapen tjener til å brukes som tilsetningsstoff i vaskemidler.
Syntese
Hvordan produseres eller syntetiseres natriumfosfat? For å gjøre dette er det basert på fosforsyre, h3Po4, eller fra salt fosfat saltnatrium, nah2Po4.
I det store flertallet av syntese er h foretrukket3Po4. Dermed blir H reagert3Po4 Med en base som nøytraliserer sine tre OH -grupper, tar du i betraktning at denne syren også kan skrives som PO (OH)3.
Kan tjene deg: Emnebalanse: Hva er, generell ligning, typerBasen etter preferanse er natriumhydroksyd, NaOH (i Tyskland), men den er også levedyktig (og billigere) å bruke natriumkarbonat eller Sosas aske, Na2Co3 (i USA). Ligningene for begge nøytraliseringsreaksjonene er:
Na2Co3 + H3Po4 → Na2Hpo4 + Co2 + H2ENTEN
Na2Hpo4 + NaOH → Na3Po4 + H2ENTEN
Merk at når du bruker NA2Co3 NA er ikke oppnådd3Po4 Men na2Hpo4, som vil trenge etterfølgende nøytralisering. Å være den vandige reaksjonen betyr, krystalliserer Na3Po4· 12H2Eller så må det beregnes for å eliminere vanninnholdet og forårsake vannfritt salt.
Deretter en3Po4· 12H2O Det er preget av å "slå sammen" krystaller i en vanskelig kompakt masse. Jo mindre størrelsen på krystallene deres, jo raskere vil kalsinering være.
applikasjoner
Mat
 Natriumfosfat brukes som et sprudlende middel for å utvide kanelroller eller kaker. Kilde: Pixabay.
Natriumfosfat brukes som et sprudlende middel for å utvide kanelroller eller kaker. Kilde: Pixabay. I natriumfosfatbruk er det uunngåelig å blande NA3Po4 eller na3Po4· 12H2Eller fordi sistnevnte er hydratet som markedsføres mest. For eksempel gir en av de to ufarlige (i teorien) ioner til maten de blir tilsatt til, beriker dem av fosfater og øker samtidig saltholdigheten.
I kjøttet av kjøttet, na3Po4· 12H2Eller er inkludert for å holde dem friske lenger under lagringen. Det tilsettes også som et emulgerende middel slik at oljevannsblandingen ikke blir "kuttet", men forblir forent; Og som pH -regulator, fordi det hjelper med å redusere surheten i maten (inkludert korn).
Kan tjene deg: kalsiumsilikat: egenskaper, struktur, få, brukI tillegg brukes den til å tykne noen tomatsauser, og for kake eller brødbaking (overlegen bilde). Sistnevnte skyldes at na3Po4· 12H2Eller har en tendens til å frigjøre vanndamp, noe som øker størrelsen på porene på melmassen og volumet av det samme.
Vaskemidler
Natriumfosfat er grunnleggende nok til å saponifisere noen fett eller oljer som du har kontakt. Dets alkalinitet brukes deretter til å forbedre virkningen av vaskemidler, så lenge overflaten til elendighet ikke er metall, da de kan forringes den.
Imidlertid er produksjonen av vaskemidler beriket med fosfater blitt redusert fordi de produserer eutrofiering av innsjøer og elver, og med det spredning av alger som dekker overflatene.
Det har også blitt brukt til utdyping av et desinfeksjonsmiddel: NA3Po4· 1/4naocl · 11H2Eller, som tilberedes ved bruk av natriumhypokloritt, naoCl, i stedet for NaOH eller Na2Co3 Å nøytralisere h3Po4.
Medisin
Deretter en3Po4 Det induserer avføring ved å fungere som et hyperosmotisk avføringsmiddel, nødvendig for å rengjøre tykktarmen før pasienten gjennomgår en koloskopi. På den annen side har den også blitt brukt (lagt til) i energitilskudd.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Nasjonalt senter for bioteknologiinformasjon. (2019). Trisodiumfosfat. PubChem -database. CID = 24243. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Trisodiumfosfat. Hentet fra: i.Wikipedia.org
- Curran m.P. & Plosker G.L. (2004). Oral natriumfosfatoppløsning: en gjennomgang av bruken til kolorektal rensemiddel. Doi: 10.2165/00003495-200464150-00009
- Corey Whelan. (22. desember 2017). Natriumfosfat. Gjenopprettet fra: Healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Prosess for produksjon av trisodiumfosfat. Hentet fra: FreePatentssonline.com
- Maryann Marks. (2018). Hvorfor blir trisodiumfosfat (TSP) tilsatt maten vår? Gjenopprettet fra: TheingredientGuru.com

