Semi -utviklet formel hva er og eksempler (metan, propan, butan ...)
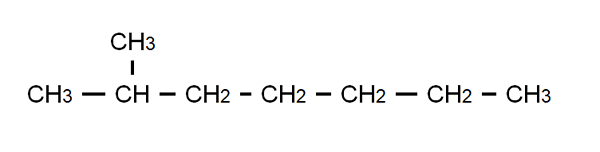
- 4334
- 1308
- Anders Mathisen
De Semi -utviklet formel, Også kjent som den halvstrukturelle formelen, er det en av de mange mulige representasjonene som kan gis til molekylet til en forbindelse. Det er veldig tilbakevendende i organisk kjemi, spesielt i akademiske tekster, for med det vises riktig rekkefølge av et molekyl og dets kovalente bindinger.
I motsetning til den utviklede formelen, som blir den samme som strukturformelen, viser den ikke C-H-bindingene, og utelater dem for å forenkle representasjonen. Fra denne formelen vil enhver leser kunne forstå hva skjelettet til et molekyl er; Men ikke dens geometri eller noen av de stereokjemiske aspektene.
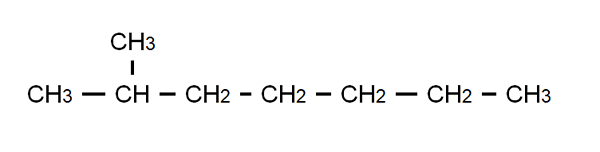 Semi-utviklet formel av 2-metylheptano. Kilde: Gabriel Bolívar.
Semi-utviklet formel av 2-metylheptano. Kilde: Gabriel Bolívar. For å avklare dette punktet har vi den halvutviklede formelen til 2-metylheptano: en forgrenet alkan hvis molekylære formel er C er8H18, Og det adlyder den generelle formelen CnH2n+2. Merk at den molekylære formelen sier absolutt ingenting om strukturen, mens den semi -utviklede den gjør det mulig å visualisere hva denne strukturen er.
Legg også merke til at C-H-bindinger er utelatt, og fremhever bare C-C-bindingene som utgjør den kullsyreholdige kjeden eller skjelettet. Det vil sees at for enkle molekyler sammenfaller den utviklede formelen med den kondenserte formelen; og til og med, med molekylær.
[TOC]
Eksempler
Metan
Den molekylære formelen til metan er CHO4, Vel, den har fire C-H-koblinger og er tetrahedral geometri. Disse dataene er gitt av strukturformelen med kiler utenfor eller under flyet. For metan blir den kondenserte formelen også Cho4, Som empirisk og semi -utviklet. Dette er den eneste forbindelsen som nevnte singularitet er oppfylt.
Årsaken til at den halvutviklede formelen til metan er CHO4, Det er fordi C-H-koblingene deres ikke er skrevet; For å gjøre det, ville det samsvare med strukturformelen.
Kan tjene deg: solvasjonPropan
Den halvutviklede formelen til propan er CHO3-Ch2-Ch3, har bare to C-C-lenker. Molekylet er lineært, og hvis det viser, er den kondenserte formelen nøyaktig den samme: Cho3Ch2Ch3, Med den eneste forskjellen som C-C-koblinger er utelatt. For propan er det oppfylt at både den semi -utviklede og kondenserte formelen sammenfaller.
Dette er faktisk oppfylt for alle alkaner av lineære kjeder, da det fortsetter å bli sett i de følgende seksjonene.
Butan
Den halvutviklede butanformelen er Cho3-Ch2-Ch2-Ch3. Merk at det kan skrives på samme linje. Denne formelen strengt tatt tilsvarer den til n-Butan, som indikerer at det er den lineære og ubørste isomeren. Den forgrenede isomeren, 2-metylpropan, kommer til å ha følgende halvutviklede formel:
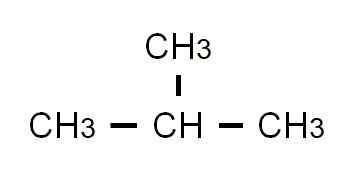 Semi-utviklet formel av 2-metylpropan. Kilde: Gabriel Bolívar.
Semi-utviklet formel av 2-metylpropan. Kilde: Gabriel Bolívar. Denne gangen kan det ikke lenger skrives eller representeres i samme linje. Disse to isomerer har den samme molekylære formelen: C4H10, som ikke tjener til å diskriminere fra hverandre.
Pentano
Vi har en annen alkan igjen: pentanen, hvis molekylære formel er c5H12. Den semi -utviklede formelen til n-Pentano er Ch3-Ch2-Ch2-Ch2-Ch3, Lett å representere og tolke, uten behov for å plassere C-H-koblingene. Gruppene kap3 De er den så -kalt metyl eller metyl, og valgene2 De er metylen.
Pentanen har andre forgrenede strukturelle isomerer, som er observert i det nedre bildet representert av deres respektive semi -utviklede formler:
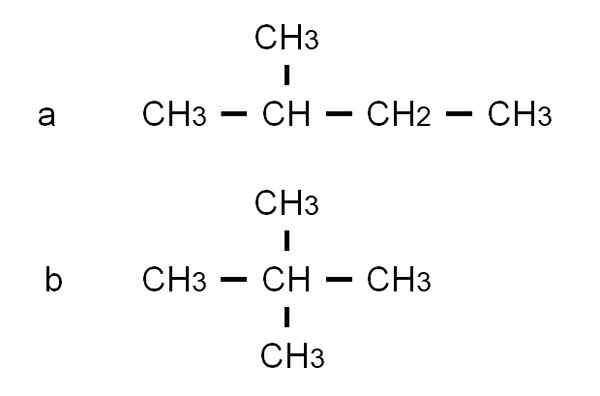 Semi -utviklede formler av de to forgrenede isomerer av pentanen. Kilde: Gabriel Bolívar.
Semi -utviklede formler av de to forgrenede isomerer av pentanen. Kilde: Gabriel Bolívar. Isomeren til Det er 2-metylbutan, også kalt isopentano. I mellomtiden isomeren b Det er 2,2-dimetylpropan, også kjent som Neopentano. Dens semi -utviklede formler tydeliggjør forskjellen mellom de to isomerer; Men han sier ikke så mye om hvordan slike molekyler ville se ut i verdensrommet. For å gjøre dette vil strukturelle formler og modeller ta.
Kan tjene deg: sulfonsyre: struktur, nomenklatur, egenskaper, brukEtanol
Semi -utviklede formler brukes ikke bare til alkaner, alkener eller alkyner, men for noen form for organisk forbindelse. Dermed har etanol, en alkohol, en halvutviklet formel: CH3-Ch2-Åh. Merk at en C-O-kobling nå er representert, men ikke O-H-koblingen. Alle hydrogenbindinger blir foraktet.
Lineære alkoholer er enkle å representere akkurat som alkaner. Oppsummert: Alle semi -utviklede formler av lineære molekyler er enkle å skrive.
Dimetyléter
Eterne kan også være representert med semi -utviklede formler. Når det gjelder dimetyléter, hvis molekylære formel er c2H6Eller, det semi -utviklede er: cho3-O-CH3. Merk at dimetyléter og etanol er strukturelle isomerer, da de deler den samme molekylære formelen (fortell atomene til C, H og O).
Cyclohexan
Semi -utviklede formler for forgrenede forbindelser er mer kjedelige å representere enn lineære; Men det er fortsatt flere av sykliske forbindelser, for eksempel cyclohexan. Dens molekylære formel tilsvarer den som for heksen og dens strukturelle isomerer: C6H12, Siden den sekskantede ringen teller som en umettethet.
For å representere cykloheksanen er en sekskantet ring tegnet på hvis toppunkter metylengruppene vil være lokalisert, CH2, Akkurat som sett nedenfor:
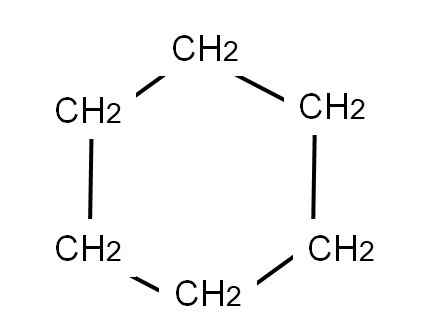 Cyclohexan semi -utviklet formel. Kilde: Gabriel Bolívar.
Cyclohexan semi -utviklet formel. Kilde: Gabriel Bolívar. Den utviklede formelen til sykloheksanen ville vise C-H-koblingene, som om ringen hadde "antenner" av TV.
Fosforsyre
Den molekylære formelen til fosforesyre er h3Po3. For mange uorganiske forbindelser er den molekylære formelen nok til å ha en ide om strukturen. Men det er flere unntak, og dette er en av dem. Med det faktum at h3Po3 Det er en diprotsyre, den semi -utviklede formelen er: HPO (OH)2.
Kan tjene deg: Neopentil: Struktur, egenskaper, nomenklatur, treningDet vil si at et av hydrogenene er direkte knyttet til fosforatomet. Imidlertid formel h3Po3 Den innrømmer også et molekyl med semi -utviklet formel: PO (OH)3. Begge er faktisk det som er kjent av tautomerer.
Semi -utviklede formler i uorganisk kjemi er veldig lik de som er kondensert i organisk kjemi. I uorganiske forbindelser, for ikke å ha C-H-bindinger, og for å være enklere, er deres molekylære formler vanligvis til å beskrive dem (når de er kovalente forbindelser).
Generell kommentar
Semi -utviklede formler er veldig vanlig når studenten lærer reglene for nomenklaturen. Men når kjemi -merknadene en gang ble assimilert, er kjemi -notatene overfylt med skjelettstrukturformler; Det vil si at ikke bare C-H-koblingene er utelatt, men sparer også tid når du ignorerer C.
For resten, i organisk kjemi, er kondenserte formler mer tilbakevendende enn de semi -utviklede, siden førstnevnte ikke trenger engang å skrive koblingene som i andre. Og når det gjelder uorganisk kjemi, er disse halvutviklede formlene mindre brukt.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2020). Semi -utviklet formel. Gjenopprettet fra: er.Wikipedia.org
- Siyavula. (s.F.). Organiske molekylære strukturer. Gjenopprettet fra: Siyavula.com
- Jean Kim & Kristina Bonnett. (5. juni 2019). Tegne organiske strukturer. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Lærere. Marl og JLA. (s.F.). Introduksjon til karbonforbindelser. [PDF]. Hentet fra: IPN.MX
- « Bærekraftig forbruk for hva som er bruk, betydning, handlinger, eksempler
- Vendbare reaksjonsegenskaper og eksempler »

