Van der Waals styrker
- 4643
- 1485
- Prof. Oskar Aas
Vi forklarer hva van der Waals er kreftene, deres egenskaper, typer og gir eksempler i hver
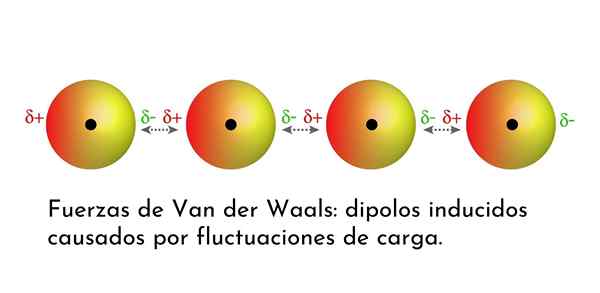
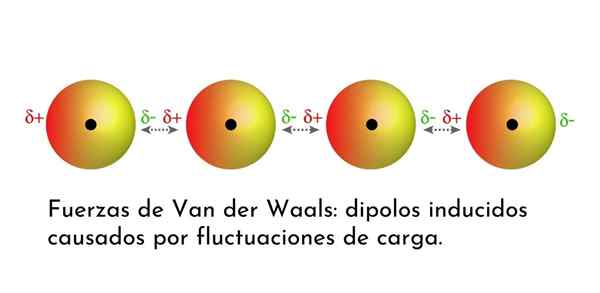 Illustrasjon som viser en av van der Waals 'styrker, Londons spredningskrefter, blant flere atomer med øyeblikkelig dipol
Illustrasjon som viser en av van der Waals 'styrker, Londons spredningskrefter, blant flere atomer med øyeblikkelig dipol Hva er Van der Waals krefter?
De Van der Waals styrker De er et sett med kort -range attraksjonskrefter mellom alle atomer og molekyler. De mottar navnet sitt til ære for den nederlandske forskeren Johannes Diderik van der Waals.
Disse kreftene er relativt svake, men vises på hele kontaktoverflaten mellom to atomer, mellom to molekyler eller mellom to overflater, så hvis nevnte kontaktflate er stor, kan van der Waals krefter bli betydelig.
Forståelsen av van der Waals krefter tillater kvalitativt å forutsi mange fysiske egenskaper til kjemiske stoffer, for eksempel smelte- og kokepunkter og løselighet i forskjellige typer løsemidler. Dette er kreftene som tillater å forklare hvordan det er mulig at en monoatomisk gass som helium, som ikke danner noen form for kjemisk binding, kan kondensere og bevege seg til flytende tilstand.
Disse kreftene forklarer også hvorfor et stoff som vann, som dannes av molekyler hvis molmasse bare er 18 g/mol, er væske, mens klor, som veier nesten 4 ganger mer, er en gass ved romtemperatur.
Kjennetegn ved van der Waals krefter
I tillegg til å representere en type attraksjonskraft mellom atomer og molekyler, deler ikke Van der Waals krefter mange egenskaper med kjemiske bindinger. Deretter presenteres de mest fremragende egenskapene til denne typen krefter:
- De er krefter avhengig av avstanden. I det enkleste tilfellet avtar de med kvadratet på avstanden. I tillegg er de sterkt avhengige av molekylær geometri.
- Sammenlignet med attraksjonskreftene som oppstår i ioniske, kovalente og metalliske koblinger, er van der Waals krefter relativt svake.
- Med unntak av dipol-dipolo-interaksjoner, er de uavhengige temperaturinteraksjoner.
- De er korte styrker, noe som betyr at de raskt avtar når atomer og molekyler beveger seg bort.
- De er generelle krefter som oppstår mellom ethvert atom og ethvert molekyl.
- I motsetning til kovalente bindinger, har de ingen retninger. Dette betyr at uavhengig av orienteringen som to molekyler nærmer seg, hvis de nærmer seg nok, vil van der Waals krefter alltid vises.
- Når to molekyler eller atomer nærmer seg for mye, blir kraften frastøtende, noe som forhindrer molekylene fra å kollapse hverandre.
- De er additive, noe som betyr at til tross for at de er betydelig svak, kan eksistensen av mange samtidige interaksjoner føre til at total attraksjonskraft er betydelig.
Typer van der Waals styrker
I tillegg til den frastøtende komponenten som sikrer at atomer og molekyler ikke kollapser, er det tre typer van der Waals -krefter, som kanskje eller ikke fungerer samtidig mellom to molekyler eller atomer. Disse presenteres nedenfor:
1. Dipolo-dipolo-interaksjoner eller Keesom-krefter
Keesoms styrke er en av skattebetalerne til kraften til van der Waals. Dette er de elektrostatiske interaksjonskreftene som vises blant de permanente dipolene til polare molekyler som vann, aceton og andre.
Keesoms krefter ligner på elektrostatiske krefter mellom ioner, men skiller seg fra disse ved at de er mye svakere og forfall med den sjette avstandskraften (det vil si med r6). Årsaken til at de er svakere, er at attraksjonen oppstår mellom delvise belastninger på en dipol, i stedet for hele elektriske ladninger som i tilfelle av ioner.
Disse interaksjonene er bare gitt mellom molekyler og ikke mellom atomer, siden atomer ikke har permanente dipolmomenter. I tillegg er Keesoms kraft omvendt proporsjonal med temperaturen, noe som betyr at når den øker, reduseres Keesoms kraft.
Eksempler på molekyler som har dipol-dipolo-interaksjoner
Alle polare molekyler har dipol-dipol-interaksjoner mellom dem. For eksempel:
- To acetonmolekyler.
- To kloroformmolekyler.
- Et sykloheksanonmolekyl med et acetonmolekyl.
2. Induserte dipolo-dipolo-interaksjoner eller Debye-krefter
Når et polært molekyl nærmer seg et atom eller et apolært molekyl, tiltrekker dipolen til den første eller gjentar elektroner på overflaten av sekundet. Dette induserer en dipol i det apolare molekylet, som kalles indusert dipol. Den nye doren dannet, samhandler deretter med den originale dipolen som skaper en liten tiltrekningskraft.
Kan tjene deg: ForbrenningsvarmeDisse interaksjonene mellom en permanent og indusert dipol er vanligvis kjent som Debye -krefter, og avhenger ikke bare av avstanden mellom de to molekylene eller mellom polarmolekylet og et individuelt atom, men er også avhengig av polariserbarheten til det apolære molekylet og størrelsesorden av dipolmomentet til det polare molekylet.
Eksempler på molekyler som har indusert dipol-dipol-interaksjoner
Denne typen interaksjoner er bare gitt mellom forskjellige molekyler, siden den ene er nødvendig for å være polar og at den andre ikke gjør det. Noen eksempler er:
- Et atom av en edel gass som argon og en polar forbindelse som hydrogenklorid. I dette tilfellet tiltrekker den positive delvise belastningen i HCl -hydrogen Valencia -elektronene til argon, og genererer en liten dipol indusert i sistnevnte. Hvis en argon nærmer seg kloratomet, vil den negative delvise belastningen avvise valenselektronene og en indusert dipol dannes også.
- Molekylær brominat (BR2) Det er betydelig løselig i vann, til tross for at han er en apolar forbindelse og vannet til et sterkt polært løsningsmiddel. Forklaringen skyldes delvis den høye polariserbarheten av bromen som lar deg danne betydelig sterke interaksjoner.
3. Induserte dipolo-dipolo induserte interaksjoner eller spredningskrefter i London
Av alle van der Waals styrker er de svakeste Londons spredningskrefter. Disse interaksjonene er gitt mellom alle atomer og molekyler på grunn av utseendet til øyeblikkelig dipoler i noen del av strukturen.
En øyeblikkelig dipol er en liten dipol som dannes ved en asymmetrisk fordeling av valenselektroner på et gitt tidspunkt.
Kan tjene deg: umettede hydrokarbonerHvordan genereres øyeblikkelig dipoler?
Ettersom elektroner dreier seg om kjernen, kan det skje at det på en gang er flere elektroner på den ene siden enn fra den andre, noe som gir opphav til en dipol. Denne lille dipolen forsvinner raskt når elektroner fortsetter å bevege seg rundt kjernen, og det er derfor de kalles øyeblikksbilder.
Øyeblikkelig dipoler kan oppstå hvor som helst i strukturen til et molekyl, og til enhver tid kan det være mange av dem. London -spredningskrefter består av samspillet mellom disse øyeblikkelige tider i ett molekyl og et annet.
Eksempler på forbindelser som har spredningskrefter i London
Som nevnt oppstår denne typen interaksjoner mellom alle atomer og molekyler. Imidlertid er det i de store apolare molekylene der dens virkning kan observeres bedre, siden det i disse tilfellene er den eneste typen intermolekylær interaksjon som oppstår.
Et typisk eksempel der disse kreftene er veldig intense er i tilfelle av langkjeden alifatiske hydrokarboner, spesielt i polymerer som polyetylen.

