Intermolekylære krefter
- 1374
- 323
- Marius Aasen
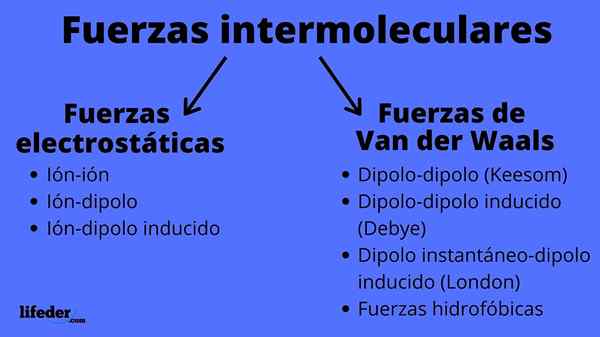
 Skjema for intermolekylære krefter typer
Skjema for intermolekylære krefter typer Hva er intermolekylære krefter?
De Intermolekylære krefter De er et sett med interaksjoner som foregår mellom molekylene, enten av den samme kjemiske forbindelsen eller ikke, og som holder dem sammen. Takket være disse kreftene klarer molekylene å gruppere og definere et faststoff, væske eller gass; det vil si at de er ansvarlige for de fysiske egenskapene til stoffer.
Intermolekylære krefter kan være av to typer: elektrostatisk eller van der Waals. De elektrostatiske er alle de der vi har ioner, som er elektrisk belastede atomer eller molekyler (+ eller -). I mellomtiden involverer de av van der Waals nøytrale atomer eller molekyler, som ved svingninger i deres elektroniske fordeling er polarisert og tiltrukket eller frastøtt med hverandre.
Intermolekylære krefter kan sammenlignes med den eksisterende foreningen mellom forskjellige biter av lekfolk. Avhengig av deres former og retningslinjer, blir fagforeningene deres svakere eller svakere, akkurat når de endrer design og endelige dimensjoner av konstruksjonen.
Jo sterkere disse kreftene er, jo vanskeligere vil det være å skille bitene av lekfolk eller, i tilfelle av kjemi, molekylene. Dette betyr også at det vil være større komprimering, og at molekylene derfor vil definere mer tyktflytende væsker, tyngre eller tettere gasser.
Andre fysiske egenskaper som fusjon og kokepunkter, volatilitet, tekstur osv., De er også makroskopiske reflekser fra de intermolekylære kreftene som styrer mellom molekylene eller ionene til en forbindelse eller blandinger. For eksempel: for eksempel de intermolekylære kreftene til gassene er veldig svake sammenlignet med en stein.
Å forstå intermolekylære krefter er avgjørende for å beskrive mange av de kjemiske, fysiske og biologiske begrepene.
Elektrostatiske krefter
Ionion
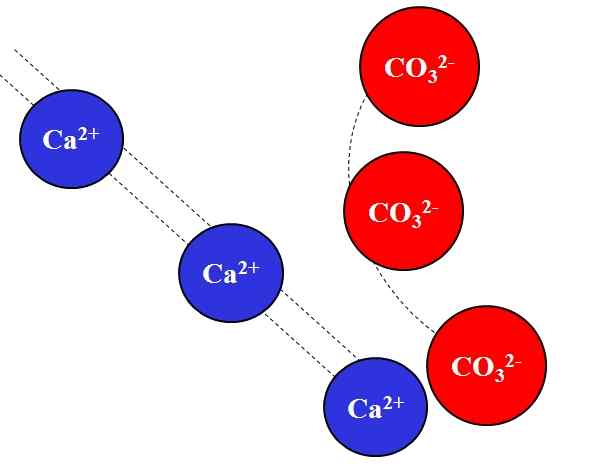 Elektrostatisk tiltrekning mellom Ca2+ og CO32 -ioner-. Kilde: Gabriel Bolívar.
Elektrostatisk tiltrekning mellom Ca2+ og CO32 -ioner-. Kilde: Gabriel Bolívar. Motsatte anklager ioner tiltrekker seg med stor styrke, som skyldes Coulombs lov, og reduserer raskt jo mer ionene beveger seg bort.
For eksempel CA -ionen2+ Det er positiv ladning, en kation, mens CO32- Det er et negativt belastningsion, en anion. Å være dine motsatte belastninger, CA2+ og co32- De tiltrekker hverandre, og viser at jo nærmere de er, jo mer sammen vil de forbli.
Tvert imot, ioner med samme belastning, enten positive eller negative, frastøter med samme kraft, men i motsatt forstand. Dermed CA2+ Frastøt til ioner som na+, Mg2+, K+, etc., Med mindre det er andre anioner som reduserer frastøtningen.
Det kan tjene deg: Dibenzalacetona: egenskaper, reaksjonsmekanisme, bruksområder, risikoAv alle intermolekylære krefter er de av ion-ion-typen den enkleste; Men samtidig den sterkeste av alle. Mye energi eller varme er nødvendig for å skille ionene.
Ion-dipolo
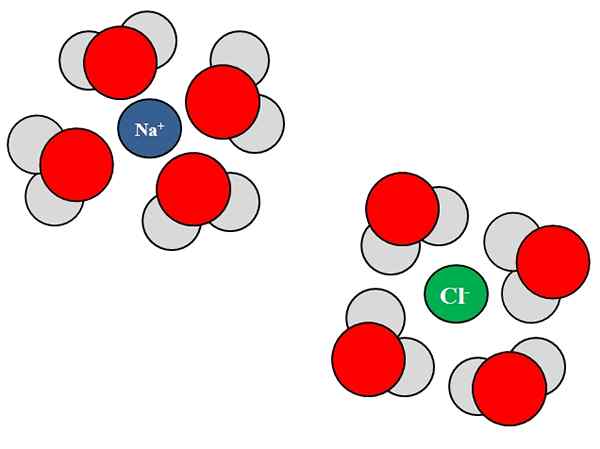 Ion-dipolo-interaksjoner mellom vannmolekyler og NaCl-ioner. Kilde: Gabriel Bolívar.
Ion-dipolo-interaksjoner mellom vannmolekyler og NaCl-ioner. Kilde: Gabriel Bolívar. Ioner kan også samhandle med nøytrale atomer eller molekyler, for eksempel vann. Dette gjelder spesielt når det gjelder molekylene til et løsningsmiddel, som solvata, det vil si omgir ionene i deres væske.
For eksempel består natriumklorid, NaCl, av NA -ioner+ og cl-. Når krystallene deres blir kastet i vannet, er vannmolekylene, h2O eller HOH, hydrat eller omgir ionene til NaCl; Men måten de gjør varierer avhengig av det aktuelle ionet.
Dermed ser vi i det overordnede bildet at ion na+ er hydrert av H h oksygenatomer2ENTEN. I mellomtiden Ion CL- er hydrert av hydrogenatomer.
Fordi? Fordi vann er et polært stoff, noe som betyr at det har en dipol: en stolpe med en positiv delvis belastning, og en annen med negativ delvis belastning.
Oksygenatomet, fordi det er mer elektronegativt, tiltrekker elektronene mot seg selv, og dermed lokaliserer elektronene oftere rundt det atomet; noe som ikke skjer det samme med hydrogenatomer, mindre elektronegativ. Oksygen, fordi det er mer negativt, er orientert mot NA+; Mens hydrogener, fordi de er mer positive, er orientert mot CL-, Siden motsatte ladninger er tiltrukket.
Indusert ion-dipolo
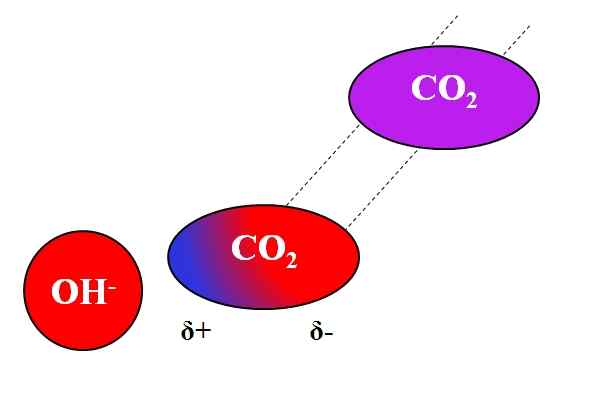 Induktiv handling oh- på co₂-molekylet. Kilde: Gabriel Bolívar.
Induktiv handling oh- på co₂-molekylet. Kilde: Gabriel Bolívar. Ikke bare polare eller dipoles molekyler kan samhandle med ioner. For nøytrale atomer eller molekyler, selv om de ikke har dipoler, er fordelingen av elektronene deres utsatt for de induktive effektene av ioner i nærheten; Det vil si at ionene forårsaker en øyeblikkelig og kort polarisering, nok for et bemerkelsesverdig samspill.
Kan tjene deg: blyacetat: struktur, egenskaper, innhenting, brukAnta for eksempel samspillet mellom Oh -ion- og co2. Co2 Det er en nøytral forbindelse, hvis molekyl (i lilla) mangler dipol. Men når OH nærmer seg-, Den negative belastningen av denne fraktet elektronene til oksygenatomene i CO2.
Jo nærmere OH er- og co2, Sterkere vil være frastøtning. Følgelig begynner en dipol indusert av OH å bli etablert- Om co2. En positiv stolpe vises Δ+ fordi elektroner, frastøt, "emigrerer" til den andre enden av molekylet.
Dermed, åh- og co2 De forblir nok sammen til å reagere med hverandre. Dette er grunnen til at CO2 Det er spesielt løselig i alkaliske løsninger.
Van der Waals styrker
Van der Waals krefter refererer i prinsippet bare til de som eksisterer mellom nøytrale atomer eller molekyler, uten ioniske belastninger.
Dipolo-Dipolo (Keesom)
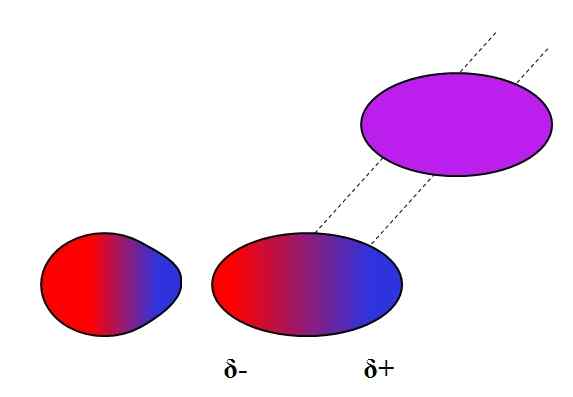
 Dipolo-Dipolo-krefter. Kilde: Gabriel Bolívar.
Dipolo-Dipolo-krefter. Kilde: Gabriel Bolívar. Motsatte ladninger er tiltrukket, like belastninger frastøtter. Det samme er tilfelle for dipolene: Motsatte poler (Δ+ og Δ-) er tiltrukket, mens like polakker avviser. De positive polene eller Δ+ er representert ovenfor med den blå fargen, men at de negative polene eller Δ- er representert med den røde fargen.
Legg merke til hvordan toppmolekylene er orientert og bestilt på en slik måte at de motsatte stolpene er, og beveger seg bort i prosessen til de samme polene. Denne bestillingen er det som er kjent som interaksjonene eller kreftene Dipolo-Dipolo (Keesom Forces), og er de viktigste intermolekylære kreftene mellom polare molekyler.
For eksempel H -molekyler2Eller, HCl, HF, CO, blant annet er de bestilt i lignende modus. Jo mer polar de er, jo sterkere vil dipol-dipolo-kreftene være; Og derfor vil det være vanskeligere det vil være å skille molekylene deres.
HF er mer polar enn HCl, så kokepunktet til HF er overlegen (19.5 ºC) til HCl (-85.05 ºC). Det er utrolig effekten som intermolekylære krefter har på fysiske egenskaper. Den minste variasjonen, og stoffet vil oppføre seg helt annerledes enn det som var forventet.
Kan tjene deg: Gassformstilstand: Kjennetegn, generell lov, eksemplerIndusert Dipolo-Dipolo (Debye)
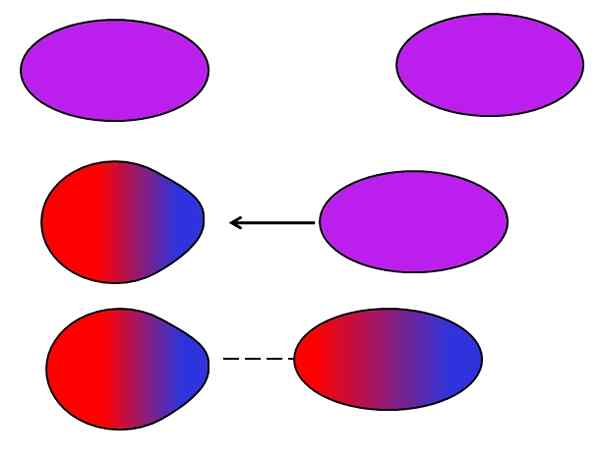
 Indusert dipolo-dipolo. Kilde: Gabriel Bolívar.
Indusert dipolo-dipolo. Kilde: Gabriel Bolívar. Dipolos, som ioner, kan også svinge eller påvirke den elektroniske fordelingen av nøytrale atomer eller molekyler. Dermed ser vi, i det overlegne bildet, at en dipol plutselig polariserer et nøytralt molekyl. Det sies derfor at det er en indusert dipol-dipolkraft, fordi den andre dipolen er øyeblikkelig, ikke permanent.
For eksempel er vann i stand til å løse opp en liten mengde eller2, Men nok til at marin fauna kan puste. Hvis h2Eller kunne ikke indusere en dipol i O2, Alt oksygenet i havene ville slippe unna overflaten, fordi det ikke ville være noen interaksjoner mellom begge molekyler.
Øyeblikkelig Dipolo-indusert Dipolo (London)
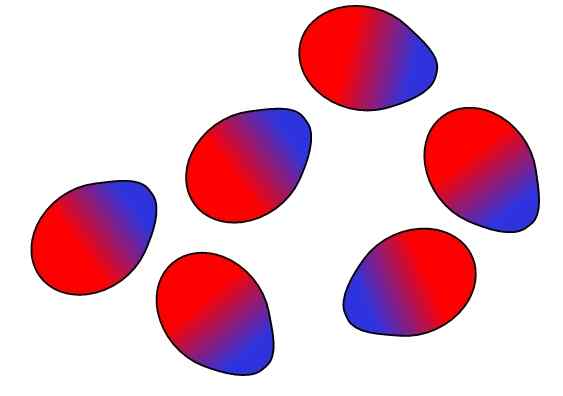
 London Forces. Kilde: Gabriel Bolívar.
London Forces. Kilde: Gabriel Bolívar. Nøytrale atomer eller molekyler trenger ikke naboer eller dipoler for å lide for seg svingninger i fordelingen av deres indre belastninger. Elektronene er ikke stille, men beveger seg gjennom molekylet. På et tidspunkt vil en øyeblikkelig dipol finne sted, som hvis den er veldig nær et nøytralt molekyl eller atom, vil indusere en dipol i dem (se over).
Jo større og asymmetrisk disse molekylene, jo mer sannsynlig vil det oppstå øyeblikkelige dipoler. Det er grunnen til at forbindelsene til de høyeste atommassene har en indusert øyeblikkelig dipol-krefter-indusert mer intense. Denne typen van der Waals -styrker er bedre kjent som London -styrker.
For eksempel edle gasser (han, ne, ar osv.) De forblir samlet takket være London -styrkene, akkurat som luftgasser (eller2, N2, Co2, etc.). Også denne styrken er den mest dominerende blant hydrokarboner som metan, Cho4, Og propan, cho3Ch2Ch3.
Hydrofobe krefter
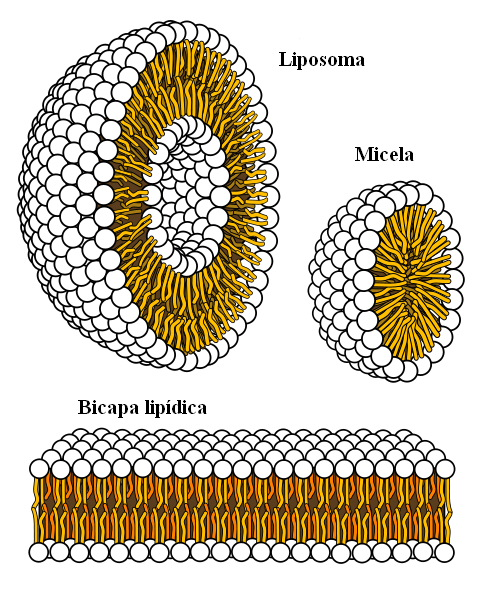 Supramolekylære strukturer stammer fra hydrofobe krefter
Supramolekylære strukturer stammer fra hydrofobe krefter Til slutt har vi hydrofobe krefter, som er et spesielt resultat av London -styrker og frastøtninger mellom stoffer med forskjellige polariteter. Fett er lite relatert til vann, så det er uoppløselig i dette.
Fettmolekyler søker å gruppere seg på en slik måte at interaksjonene deres med vann er så mye som mulig, og dette klarer å danne 3D -strukturer som de som er vist ovenfor.
Dermed kommer fettmolekyler, som fosfolipider, sammen for å danne lipid -dobbeltlag, miceller og liposomer.
Hvis de er observert, har disse molekylene et hvitt hode som representerer en polar del, relatert til vann; så vel som en apolar hale, som frastøter vannmolekylene. Linjene prøver å plassere seg inne i disse supramolekylære strukturene, slik at de ikke samhandler med vann.

