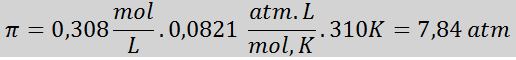Kolligative egenskaper til løsninger
- 4635
- 5
- Jonathan Carlsen
Hva er kollegative egenskaper?
De Kolligative egenskaper, De er også kalt kollektive egenskaper til løsninger, de er en gruppe på fire egenskaper som utelukkende er avhengige av mengden partikler som er til stede i løsningen, men ikke av disse partiklenes natur.
Med andre ord, disse egenskapene oppstår fra tilstedeværelsen av andre partikler enn løsningsmidlet, det vil si partikler av løst stoffet, men ikke avhenger av hvem løsten er. Enhver type partikkel kan gi opphav til kollegative egenskaper, uansett om det er atomer, ioner eller molekyler. Det eneste som betyr noe er konsentrasjonen din.
De kollegative egenskapene er fire:
- Beslutning om damptrykket til løsningsmidlet
- Ebullloskopisk høyde
- Krioskopisk avstamning
- Osmotisk trykk
Alle er preget av å være proporsjonale med konsentrasjonen av oppløsningen i tilfelle av relativt utvannede oppløsninger (konsentrasjon <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
La oss se hver av disse fire egenskapene i detalj:
1. Beslutning om damptrykket til løsningsmidlet
Når en ikke -flyktig oppløselig løsning er fremstilt, er damptrykket til den resulterende løsningen alltid mindre enn damptrykket til det rene løsningsmidlet. Oppløs med andre ord et ikke -flyktig stoff i et løsningsmiddel, forårsaker en reduksjon i damptrykket til nevnte løsningsmiddel, sammenlignet med det rene løsningsmidlet.
Formel for damptrykk reduseres
Som alle koligative egenskaper, er reduksjonen i damptrykk (DP) proporsjonal med konsentrasjonen av løst stoffet. Ved å kombinere Raaults lov med de molære fraksjonslikningene, kan det påvises at DP er gitt av:
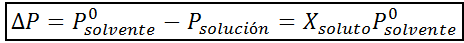
hvor p °løsemiddel representerer damptrykket til det rene løsningsmidlet ved en viss temperatur, Pløsning tilsvarer damptrykket til løsningen og xløst representerer konsentrasjonen av løsningen uttrykt som molar fraksjon.
Hvorfor reduserer damptrykket med løst stoffet?
Kraften som driver de fleste naturlige prosesser, for eksempel fordampning av et løsningsmiddel, er økningen i entropi eller lidelsesnivå. Når en væske fordamper, går den fra en veldig ordnet tilstand (i væsken) til en veldig rotete (i gass), siden det i gassfasen er mye mer bevegelsesfrihet.
Kan servere deg: fiolett glassI en løsning gir imidlertid tilstedeværelsen av løsningen lidelse til væskefasen mens den ikke påvirker gassfasen (siden løsningen ikke fordamper).
Av denne grunn er forskjellen i lidelsesnivået mellom løsningen og gassfasen mindre enn mellom det rene løsningsmidlet og gassfasen, så løsningsmidlet har mindre tendens til å fordampe i det andre tilfellet.
Eksempel
Problem: Når du vet at vanndamptrykket ved en viss temperatur er 30,55 mmHg, må du bestemme damptrykket til en forberedt oppløsning som løser opp 7,20 gram glukose (molmasse eller mm = 180 g/mol) i 360 g vann (mm = 18,0 g/mol) ved samme temperatur.
Løsning: I dette tilfellet må den molære brøkdelen av oppløsningen beregnes først. Vi har allerede alle nødvendige data for dette:
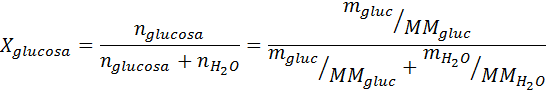
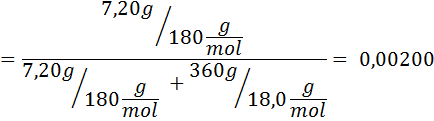
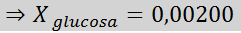
Deretter blir ligningen for damptrykknedgang påført.
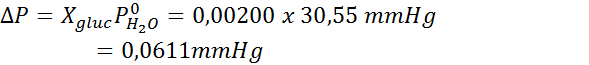
Nå bestemmer vi det nye damptrykket til løsningsmidlet:
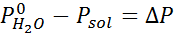
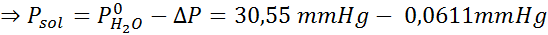
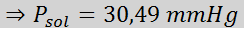
2. Ebullloskopisk høyde eller kokepunkt
Ebullloskopisk høyde refererer til økningen i kokepunktet i en løsning sammenlignet med kokepunktet for rent løsningsmiddel. For å forstå hvorfor dette skjer, husk at kokepunktet er definert som temperaturen som damptrykket til en væske gjøres lik atmosfæretrykk.
Ettersom løsningene har et mindre damptrykk enn det rene løsningsmidlet (som vi nettopp har sett i forrige seksjon), er det nødvendig å varme det mer for å kunne nå atmosfæretrykk og dermed nå kokepunktet. Av denne grunn er kokepunktet for løsningene (med ikke -flyktige oppløsninger) alltid større enn det for det rene løsningsmidlet.
Ebullloskopisk høydeformel
Økningen i kokepunktet (DTb) Det er proporsjonalt med konsentrasjonen av løsningen uttrykt i molealitet, som indikert med følgende ligning:
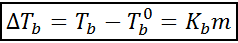
Hvor tb Det er kokepunktet med løsningen, tb° Det er kokepunktet for rent løsningsmiddel, kb Det er den ebullloskopiske konstanten til løsningsmidlet og m Det er møllen til løst stoffet.
Eksempel
Problem: Å vite at kokekonstanten til vann er 0,52 ° C.kg/mol, bestemme kokepunktet for glukoseløsningen fremstilt i forrige eksempel.
Løsning: For å bestemme den ebullloskopiske høyden trenger vi bare moral.
Kan tjene deg: tinnoksid (ii): struktur, egenskaper, nomenklatur, bruk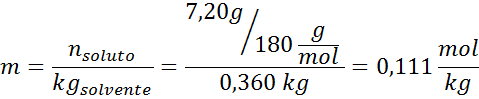
Nå bruker vi DT -formelenb:
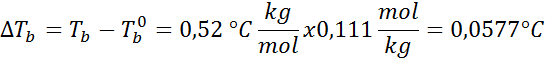
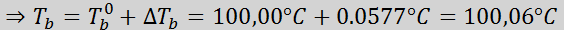
3. Krioskopisk avstamning
Den kryoskopiske reduksjonen er reduksjonen i frysepunktet til en løsning sammenlignet med frysepunktet til det rene løsningsmidlet. Årsaken til at dette skjer ligner på den ebullloskopiske økningen og har sin opprinnelse i reduksjonen i damptrykk.
Denne eiendommen er mye brukt i kaldt vær der den snør om vinteren. I disse landene er det veldig vanlig å se lastebiler spre salter som NaCl eller CACL2 på veier eller på offentlige benker, hvoretter Snow smelter. Årsaken til at det smelter er at salt reduserer vannfrysningspunktet.
Krioskopisk nedstigningsformel
Den chrioskopiske nedstigningsligningen er veldig lik den for den ebullloskopiske økningen. Det er også proporsjonalt med den moralske konsentrasjonen og avhenger i dette tilfellet av en kryoskopisk konstant av løsningsmidlet.
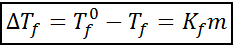
hvor tF Det er frysepunktet med løsningen, tF° Det er frysepunktet til rent løsningsmiddel, kF Det er den chrioskopiske konstanten til løsningsmidlet og m Det er møllen til løst stoffet.
Eksempel
Problem: Å vite at den kryoskopiske vannkonstanten er 1,86 ° C.kg/mol, bestemme frysepunktet til glukoseløsningen fremstilt i forrige eksempel.
Løsning: Moralen i løsningen var allerede bestemt, så vi kan bestemme DT direkteF Bruke den forrige formelen:
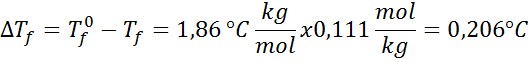
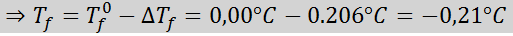
4. Osmotisk trykk
Osmose er en prosess av stor betydning på det kjemiske og biologiske nivået. Dette består av strømmen av løsningsmiddelmolekyler (for eksempel vann) fra en fortynnet løsning til en annen mer konsentrert løsning når de er atskilt ved hjelp av en semipermeabel membran (som bare lar løsningsmidlet bare passere, men ikke oppløsningen).
Denne tendensen til å "absorbere" løsningsmiddel gjennom en semipermeabel membran er en egenskap som utelukkende avhenger av den totale konsentrasjonen av oppløste partikler som er tilstede i løsningen, uavhengig av hvilken løst den er. Av denne grunn er denne trenden en kollegativ egenskap, og måles gjennom osmotisk trykk.
Osmotisk trykk (π) er trykket som bør brukes på en løsning for å stoppe osmosen. Jo større det osmotiske trykket, jo mer tendens er løsningen til å absorbere løsningsmiddel (eller mer presist, jo mer trend har løsningsmidlet å spre seg mot den løsningen) løsningen).
Kan tjene deg: magnesium: historie, struktur, egenskaper, reaksjoner, brukHvorfor oppstår osmose?
Forklaringen bak osmoseprosessen er veldig enkel. Alle stoffer har en tendens til å spre seg fra der de er mer konsentrerte der de er mer utvannet. Dette blir fortalt å følge konsentrasjonsgradienten din.
Når en løsning er mer konsentrert i løst stoff, blir den samtidig mer utvannet i løsningsmiddel og omvendt. Av denne grunn har løsningsmidlet en naturlig tendens til å gå fra den mest fortynnede løsningen (der løsningsmidlet er mer konsentrert) mot den mest konsentrerte løsningen (der den er mer fortynnet).
Osmotisk trykkformel
Osmotisk trykk kan beregnes med en formel som er veldig lik ligningen av ideelle gasser:
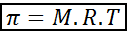
I denne ligningen er π det osmotiske trykket, M er den molare konsentrasjonen av løst stoff, r er den universelle konstanten av ideelle gasser (0,0821 atm.L/mol.K) og t er den absolutte temperaturen i k.
Osmotisk trykk og tonicitet
Osmotisk trykk er veldig viktig for funksjonen til menneskekroppen. Faktisk klassifiseres saltoppløsningene som injiseres intravenøst i henhold til om deres osmotiske trykk er større, lik eller mindre enn blodplasma til det som kalles tonicitet.
- En mindre konsentrert løsning om at plasma har et lavere osmotisk trykk og blir fortalt Hypotonisk løsning.
- Hvis du har den samme totale konsentrasjonen av oppløste stoffer blir det fortalt Isotonisk løsning.
- Hvis du har et større osmotisk (eller konsentrasjon) trykk, blir det fortalt hypertonisk løsning.
Eksempel
Problem: Beregn det osmotiske trykket ved 310 K av en 0,9% saltoppløsning (m/v), som er isoton med blodplasma.
Løsning: Vi har allerede temperaturen, så det eneste som mangler er å bestemme den molare konsentrasjonen av saltpartiklene (NaCl) i løsningen. For dette.
Hver 100 ml løsning inneholder 0,9 g NaCl, så:
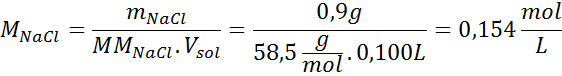
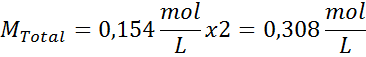
Dette er den totale konsentrasjonen av oppløste partikler i løsningen, så nå kan vi beregne det osmotiske trykket: