Ideell gassmodell, atferd, eksempler
- 4549
- 663
- Theodor Anders Hopland
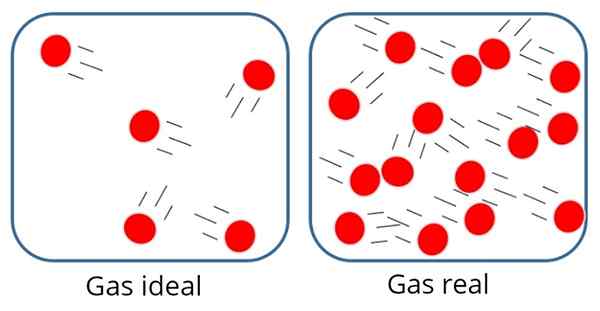
EN Ideell gass enten Perfekt gass Det er en der tiltrekningskraften eller molekylær frastøtning anses som ubetydelig mellom partiklene som komponerer den, derfor er all dens indre energi kinetisk, det vil si energi assosiert med bevegelsen.
I en slik gass er partiklene vanligvis ganske langt fra hverandre, selv om de av og til kolliderer med hverandre og med veggene i beholderen.
 I den ideelle gassen er partiklene borte fra hverandre
I den ideelle gassen er partiklene borte fra hverandre På den annen side, i den ideelle gassen, betyr ikke størrelsen eller massen til partiklene seg, siden volumet som er okkupert av dem, antas å være veldig liten sammenlignet med selve gassens volum.
Dette er selvfølgelig bare en tilnærming, fordi det i virkeligheten alltid er en viss grad av interaksjon mellom atomer og molekyler. Vi vet også at partiklene okkuperer plass og har masse.
Imidlertid fungerer disse forutsetningene ganske bra i mange tilfeller, for eksempel gasser med lav molekylvekt, i et godt spekter av trykk og temperaturer.
Gasser med høy molekylvekt, spesielt ved høyt trykk eller lave temperaturer, oppfører seg imidlertid ikke i det hele tatt som ideelle gasser og trenger andre modeller som er opprettet med det formål å beskrive dem med større presisjon.
[TOC]
Første eksperimenter
Lovene som styrer gasser er empiriske, det vil si at de oppsto fra eksperimentering. De mest bemerkelsesverdige eksperimentene ble utført over det syttende, attende og tidlige nittende århundre.
Først er de av Robert Boyle (1627-1691) og Edme Mariotte (1620-1684), som uavhengig endret press i en gass og registrerte deres endring av volum, Å finne at de var omvendt proporsjonale: ved større trykk, mindre volum.
 Robert Boyle
Robert Boyle For hans del etablerte Jacques Charles (1746-1823) det volumet og temperatur Absolutt var direkte proporsjonale, så lenge trykket forble konstant.
Det kan tjene deg: Stasjonære bølger: Formler, egenskaper, typer, eksemplerAmadeo Avogadro (1776-1856) oppdaget at to identiske volumer av forskjellige gasser inneholdt samme mengde partikler, så lenge trykket og temperaturen var det samme. Og til slutt sa Joseph de Gay Lussac (1778-1850) at ved å holde volumet fast, er trykket i en gass direkte proporsjonalt med temperaturen.
Lovene med ideelle gasser
Disse funnene kommer til uttrykk gjennom enkle formler, ringer p til presset, V til volum, n til antall partikler og T Den ideelle gasstemperaturen:
Boyle-Maleotte Law
Forutsatt at temperaturen er fast, oppstår følgende:
P⋅V = konstant
Charles Law
Når gassen er under konstant trykk:
V / t = konstant
Homofil lussac lov
Å holde gassen på et fast volum er sant at:
p / t = konstant
Avogadro Law
Identiske gassvolumer, under samme trykk og temperaturforhold har samme antall partikler. Derfor kan vi skrive:
V ∝ n
Hvor n er antall partikler og ∝ er symbolet på proporsjonalitet.
Ideell gassmodell
Den ideelle gassmodellen beskriver en gass slik at:
-Når partiklene samhandler, gjør det i veldig kort tid, gjennom elastiske sammenstøt, der drivkraften og kinetisk energi er bevart.
-Dens konstituerende partikler er punktlige, med andre ord, diameteren er mye lavere enn den gjennomsnittlige avstanden de reiser mellom en og en annen kollisjon.
-Intermolekylære krefter er ikke -eksisterende.
-Kinetisk energi er proporsjonal med temperaturen.
Monoatomiske gasser - hvis atomer ikke er knyttet til hverandre - og lav molekylvekt, i standardbetingelser med trykk og temperatur (atmosfæretrykk og 0 ºC temperatur), har de en slik oppførsel at den ideelle gassmodellen er en veldig god beskrivelse for dem.
Det kan tjene deg: Vy Canis Majoris: oppdagelse, egenskaper, struktur, trening og evolusjonIdeell gassstatuslikning
Lovene til gassene ovenfor er kombinert for å danne den generelle ligningen som styrer den ideelle gassatferden:
V ∝ n
V ∝ t
Derfor:
V ∝ n⋅t
I tillegg av Boyle's Law:
V = konstant / p
Da kan vi bekrefte det:
V = (konstant x n⋅t) / p
Konstanten kalles gass konstant Og det er betegnet med bokstav r. Med dette valget relaterer den ideelle gassligningen fire variabler som beskriver tilstanden av gass, nemlig n, r, p og t, og forlater:
P⋅V = n⋅r⋅t
Denne relativt enkle ligningen er i samsvar med lovene til ideelle gasser. For eksempel, hvis temperaturen er konstant, reduseres ligningen til Boyle-Maleotte-loven.
Gassen konstant
Som vi har sagt før, i standard temperatur- og trykkforhold, det vil si 0 ºC (273.15 k) og 1 trykkatmosfære, oppførselen til mange gasser er nær den ideelle gassen. Under disse forholdene er volumet på 1 mol gass 22.414 l.
I så fall:
R = (p⋅V) / (n⋅t) = (1 atm x 22.414 l) / (1 mol x 273.15 k) = 0.0821 atm ⋅ l /mol ⋅ k
Gasskonstant kan også uttrykkes i andre enheter, for eksempel i det internasjonale systemet hvis det er verdt:
R = 8,314 j⋅ mol-1⋅ k-1
Når et problem løses gjennom loven om ideelle gasser, er det praktisk å ta hensyn til enhetene som konstanten er uttrykt, siden det som vi kan se, er det mange muligheter.
Oppførsel av en ideell gass
Som vi har sagt, oppfører all gass i standardtrykk og temperaturforhold som er lav molekylvekt, veldig nær den ideelle gassen. Derfor er ligningen P⋅V = n⋅r⋅t aktuelt for å finne forholdet mellom de fire variablene som beskriver det: n, p, v og t.
Det kan tjene deg: Heisenberg Atomic ModelPå denne måten kan vi forestille oss en ideell gassdel låst i en beholder og dannet av bittesmå partikler, som av og til kolliderer med hverandre og med veggene i beholderen, alltid elastisk.
Dette er hva vi ser i følgende animasjon av en helium -del, en edel og monoatomisk gass:
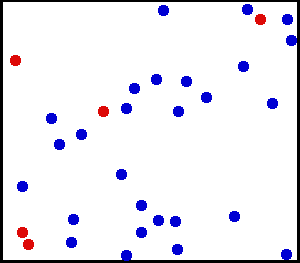 Helium er en edel gass, i animasjon er en del av heliumatomer vist i en beholder. De røde tjener til å bedre skille bevegelse. Kilde: Wikimedia Commons.
Helium er en edel gass, i animasjon er en del av heliumatomer vist i en beholder. De røde tjener til å bedre skille bevegelse. Kilde: Wikimedia Commons. Eksempler på ideelle gasser
En ideell gass er en hypotetisk gass, det vil si at det er en idealisering, men i praksis oppfører mange gasser seg på en veldig nær måte, noe.
Edle gasser
Eksempel på gasser som oppfører seg som idealer under standardbetingelser er edle gasser, så vel som lette gasser: hydrogen, oksygen og nitrogen.
Den aerostatiske ballongen
 Den ideelle gassmodellen forklarer hvordan den varme luftballongen. Kilde: Wikimedia Commons.
Den ideelle gassmodellen forklarer hvordan den varme luftballongen. Kilde: Wikimedia Commons. Til den aerostatiske ballongen i figur 1 kan brukes av Charles lov: gassen blir oppvarmet, derfor utvides luften som fyller kloden og som en konsekvens av den stiger.
Heliumballonger
Helium er sammen med hydrogen det vanligste elementet i universet, og likevel er det lite på jorden. Ettersom en edel gass er inert, i motsetning til hydrogen, er helium full ballonger mye brukt som dekorative elementer.
Referanser
- Atkins, p. 1999. Fysisk kjemi. Omega -utgaver.
- Chang, R. 2013. Kjemi. 11va. Utgave. Mc Graw Hill Education.
- Cengel, og. 2012. Termodynamikk. 7. utgave. McGraw Hill.
- Cimbala, ca. 2006. Mekanikk av væsker, grunnleggende og applikasjoner. MC. Graw Hill.
- Giambattista, a. 2010. Fysikk. 2. Ed. McGraw Hill.
- « Naturlige miljøegenskaper, elementer, betydning, eksempler
- Appellative funksjonseksempler og egenskaper »

