Gasser egenskaper, atferd, form, eksempler

- 1690
- 51
- Markus Fredriksen
De Gasser De er alle stoffene eller forbindelsene hvis aggregeringstilstander er svake og spredt, mens de er veldig avhengig av trykk- og temperaturforholdene som styrer dem. Utgjør kanskje den andre formen for materie mer rikelig i hele universet etter plasma.
I all verden utgjør gassene lagene i atmosfæren, fra eksosfæren, til troposfæren og luften vi puster. Selv om en gass er usynlig når den formidles av store områder, som himmelen, blir den oppdaget av bevegelsen av skyene, svingene på knivene på en mølle, eller av de utåndede damper i munnen vår i kaldt klima.
 Gasser kan observeres i industrielle eller hjemme skorsteiner, så vel som i røykstårn som stammer fra vulkaner. Kilde: Pxhere.
Gasser kan observeres i industrielle eller hjemme skorsteiner, så vel som i røykstårn som stammer fra vulkaner. Kilde: Pxhere. På samme måte, å gå til de miljømessige negative aspektene, observeres det i den svarte røyken fra eksosrøret til kjøretøyene, i røyksøylene på tårnene som ligger i fabrikkene, eller i røyken som er hevet når en skog brenner.
Det står også overfor gassformige fenomener når vaporer sees som forlater kloakkene, i de skjebnesvangre brannene i sumpen og kirkegårder, i Bubb -oksygen frigitt av plantenes produkt av deres fotosyntese, og til og med i erte og flatulens.
Uansett hvor gassene blir observert, betyr det at det var en kjemisk reaksjon, med mindre de er fikset eller assimilert direkte fra luften, den viktigste kilden til gasser (overfladisk) av planeten. Når temperaturen øker, vil hvert stoff (kjemiske elementer) bli omdannet til gasser, inkludert metaller som jern, gull og sølv.
Uavhengig av den kjemiske naturen til gasser, deler alle til felles den store avstanden som skiller partiklene deres (atomer, molekyler, ioner osv.), som beveger seg kaotisk og vilkårlig med et spesifikt volum eller rom.
[TOC]
Gassegenskaper
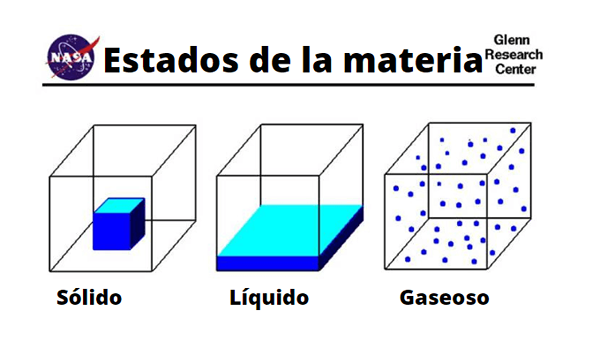 Forskjeller i faste, væske- og gassmolekyler
Forskjeller i faste, væske- og gassmolekyler Fysisk
De fysiske egenskapene til gasser varierer avhengig av hva stoff eller forbindelse er. Populært er gassene assosiert med dårlig lukt eller råte, på grunn av svovelinnholdet, eller til nærvær av flyktige aminer. På samme måte blir de visualisert av grønne, brune eller gulaktige fargestoffer, som skremmer og gir et dårlig tegn.
Imidlertid er de fleste gasser, eller i det minste de mest tallrike, faktisk fargeløse og luktfrie. Selv om de ikke er avsatt, kan de merkes på huden og motsette bevegelsesmotstand, til og med skape tyktflytende lag i kroppene som krysser dem (som med flyene).
Alle gasser kan oppleve trykk- eller temperaturendringer som ender opp med å gjøre sine respektive væsker; Det vil si at de lider kondens (hvis de er avkjølte) eller flytende (hvis de er "presset").
 Kondensasjon; av gassformig tilstand til flytende tilstand
Kondensasjon; av gassformig tilstand til flytende tilstand På den annen side er gasser i stand til å løse opp i væsker og noen porøse faste stoffer (for eksempel aktivert karbon). Bobler er resultatet av gassklynger som ennå ikke har oppløst i midten og rømmer til den flytende overflaten.
Elektrisk og termisk ledningsevne
Under normale forhold (uten ionisering av partiklene) er gasser dårlige drivere av varme og strøm. Men når de er anspente med mange elektroner, tillater de passering av strømmen gjennom dem, som sett i strålene under stormene.
På den annen side, ved lave trykk og utsatt for et elektrisk felt, brukes noen gasser, spesielt de edle eller perfekte, lyser og lysene deres brukes til utforming av natteliv og plakater (neonlys), så vel som i det berømte elektriske støtet lamper på gatelykter.
Kan tjene deg: Granataria Balanse: Karakteristikker, deler og hvordan du bruker denNår det.
Imidlertid er det gasser som er gode varmeledere, og kan forårsake dårligere forbrenninger som er forårsaket av væsker eller faste stoffer; For eksempel, som med den varme dampen til bakte kaker (eller empanadas), eller med dampstråler som unnslipper kjelene.
Reaktivitet
Generelt blir reaksjonene som involverer gasser, eller hvor de oppstår, beskrevet som farlige og tungvint.
Hans reaktivitet avhenger igjen av deres kjemiske natur; Når man utvider og mobiliserer sterkt, må mer omsorg og kontroll tas fordi de kan utløse drastiske trykkøkninger som setter strukturen til reaktoren i fare; For ikke å snakke om hvor brennbar eller ikke er glade gasser.
Gaseatferd
Makroskopisk kan man gi en ide om atferden til gasser ved å være vitne til hvordan røyk, ringer eller litterære "språk" av sigaretter utvikler seg i luften. Når en røykgranat eksploderer, er det interessant å detaljere bevegelsen til disse skyene i forskjellige farger.

Slike observasjoner er imidlertid utsatt for lufthandling, og også for at det er veldig fine faste partikler suspendert i røyk. Derfor er disse eksemplene ikke nok til å komme til en konklusjon angående en gassens sanne oppførsel. I stedet har eksperimenter blitt utført og utviklet den kinetiske teorien om gasser.
Molekylære og ideelt sett kolliderer gassformede partikler elastisk med hverandre, med lineære, rotasjons- og vibrasjonsforskyvninger. De har en gjennomsnittlig tilknyttet energi, som lar den reise fritt gjennom noe rom uten å nesten samhandle eller kollidere med en annen partikkel når volumet øker rundt dem.
Oppførselen ville være en blanding av den brownsk uberegnelige bevegelsen, og den av kollisjoner av biljardkuler som spretter ustanselig til hverandre og veggene i bordet; Hvis det ikke er noen vegger, vil de spre seg mot uendelig, med mindre de beholder dem: tyngdekraften.
Gaseform
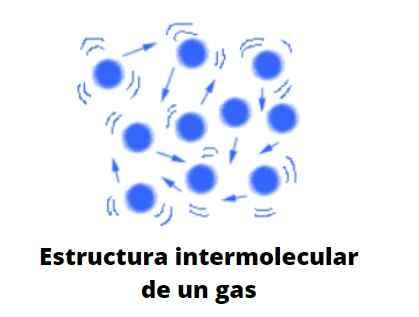
Gasser, i motsetning til væsker og faste stoffer, er ikke underlagt den kondenserte typen; det vil si at aggregeringen eller samholdet av partiklene deres aldri klarer å definere en form. De deler med væsker det faktum at de fullstendig okkuperer volumet på beholderen som inneholder dem; De mangler imidlertid overflate- og overflatespenning.
Hvis gasskonsentrasjonen er høy, kan dine "språk" eller makroskopiske former som allerede er beskrevet, visualiseres med det blotte øye. Disse, før eller senere, vil ende med å falme på grunn av vindens handling eller ved bare utvidelse av gassen. Gasser dekker derfor alle hjørner av begrenset plass og forårsaker svært homogene systemer.
Nå anser teorien praktisk som gasser som kuler som knapt kolliderer med seg selv; Men når de gjør det, spretter de elastisk.
Disse kulene er veldig atskilt fra hverandre, så gassene er praktisk talt "fulle" av vakuum; Derfra skylder du din allsidighet for å krysse den minste spalten eller sprekken, og det enkle å kunne komprimere dem betydelig.
Kan tjene deg: ikke -metalliske oksiderDet er derfor, men stengt installasjonen av et bakeri, hvis det går ved siden av, er det sikkert at aromaen til det nybakte brødet vil nytes.
Gasstrykk
Det kan antas at ved å være så spredt og separert gassfærer eller partikler, er disse ikke i stand til å generere noe trykk på kropper eller gjenstander. Atmosfæren demonstrerer imidlertid at slik tro er falsk: den har en masse, veier og forhindrer at væsker fordamper eller koker fra ingenting. Kokepunkter måles ved atmosfæretrykk.
Gasetrykk blir mer kvantifiserbare hvis manometre er tilgjengelige, eller hvis de er innelåst av ikke -deformbare veggbeholdere. Jo mer gasspartikler det er inne i beholderen, jo større er antall kollisjoner mellom dem og veggene av det samme.
Disse partiklene når de kolliderer med veggene trykker på dem, mens de utøver på overflaten en kraft proporsjonal med sin kinetiske energi. Det er som om de ideelle biljardkulene til en vegg ble overveldet; Hvis det er mange som påvirker dem i høy hastighet, kan det komme til å gå i stykker.
Enheter
Det er mange enheter som følger med trykkmålingene til en gass. Noen av de mest kjente er Millimeter of Mercury (MMHG), så vel som Torr. Er de av det internasjonale systemet med enheter (SI) som definerer Pascal (PA) når det gjelder N/M2; Og av ham, Kilo (KPA), Mega (MPA) og Giga (GPA) Pascal.
Gassvolum
En gass okkuperer og utvides gjennom hele volumet av beholderen. Jo større beholderen, gassvolumet vil også være; Men både trykket og tettheten vil avta for samme mengde partikler.
Selve gassen har derimot et tilknyttet volum som ikke er så mye avhengig av dens molekylære natur eller struktur (ideelt sett), men av trykk- og temperaturforholdene som styrer den; Dette er det molære volumet.
I virkeligheten varierer molvolumet fra en gass til en annen, selv om variasjonene er små hvis de ikke er av heterogene og store molekyler. For eksempel mololumet av ammoniakk (NH3, 22.079 l/mol) ved 0 ºC og 1 atm, den skiller seg fra helium (han, 22.435 l/mol).
Alle gasser har et molært volum som endres avhengig av P og T, og uavhengig av hvor store partiklene deres er, er antallet av dem alltid det samme. Herfra avledet han det som er kjent med Avogadro -nummeret (nTIL).
Hovedlover for gasser
Gaseatferd har studert siden tidligere århundrer gjennom eksperimenter, dype observasjoner og tolkning av resultatene.
Slike eksperimenter tillot en rekke lover som, samlet i samme ligning (den for ideelle gasser), bidrar til å forutsi svarene til en gass til forskjellige trykk- og temperaturforhold. På denne måten er det en sammenheng mellom volum, temperatur og trykk, samt antall føflekker i et bestemt system.
Blant disse lovene er følgende fire: Boyle, Charles, Gay-Lussac og Avogadro.
Boyle Law
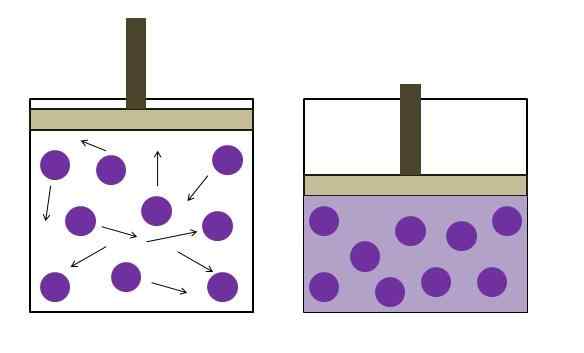 Økt trykkreduksjonstrykk. Kilde: Gabriel Bolívar
Økt trykkreduksjonstrykk. Kilde: Gabriel Bolívar Boyle's lov slår fast at ved konstant temperatur er volumet av en ideell gass omvendt proporsjonal med trykket; Dette er, jo større beholderen, jo lavere trykket som veggene vil oppleve med samme mengde gass vil oppleve.
Det kan tjene deg: Charles Law: Formler og enheter, eksperiment, øvelserCharles Law
 Kinesiske lykter eller ønsker. Kilde: Pxhere.
Kinesiske lykter eller ønsker. Kilde: Pxhere. Charles lov fastslår at ved konstant trykk er volumet av en ideell gass direkte proporsjonal med temperaturen. Ballongene demonstrerer Charles '.
Gay-Lussac Law
Gay-Lussacs lov slår fast at ved konstant volum er trykket til en ideell gass direkte proporsjonalt med temperaturen. I en godt saktet kull hvis en gass gradvis varmes opp, vil trykket inni være større, fordi veggene i kassen ikke er deform eller utvidet; Det vil si at volumet ikke endres, det er konstant.
Avogadro Law
Til slutt fastslår Avogadros lov at volumet okkupert av en ideell gass er direkte proporsjonalt med antall partikler. Det er slik at hvis du har en mol partikler (6,02 · 1023), da vil det molære volumet av gass være.
Typer gasser
Brennbare gasser
Dette er gasser hvis komponenter fungerer som drivstoff, fordi de brukes til termisk energiproduksjon. Noen av dem er naturgass, flytende olje og hydrogengass.
Industrielle gasser
Dette er produserte gasser, som markedsføres for publikum for forskjellige bruksområder og applikasjoner, for eksempel for helsesektorer, mat, miljøvern, metallurgi, kjemisk industri, sikkerhet, blant andre. Noen av disse gassene er oksygen, nitrogen, helium, klor, hydrogen, karbonmonoksid, propan, metan, lystgass, blant andre.
Inerte gasser
De er de gassene som under spesifikke temperatur- og trykkforhold ikke genererer noen kjemisk reaksjon eller en veldig lav. De er Neon, Argon, Helium, Kripton og Xenon. De brukes i kjemiske prosesser der ikke -reaktive elementer er nødvendige.
Eksempler på gassformige elementer og forbindelser
Hva er de gassformige elementene i det periodiske bordet under terrestriske forhold?
Vi har først hydrogen (H), som danner H -molekyler2. Det blir fulgt av helium (He), den lettere edelgassen; og deretter nitrogen (N), oksygen (O) og fluor (F). Disse tre siste danner også diatomiske molekyler: n2, ENTEN2 og f2.
Etter fluor kommer neon (NE), den edle gassen som følger helium. Under fluor har vi klor (CL), i form av CL -molekyler2.
Så har vi resten av Noble Gases: Argon (AR), Kripton (KR), Xenón (XE), Radon (RN) og Oganeson (OG).
Derfor er de totalt tolv gassformede elementer; Elleve hvis vi ekskluderer den svært radioaktive og ustabile Oganeson.
Gassøse forbindelser
I tillegg til gassformige elementer, vil noen vanlige gassforbindelser bli oppført:
-H2S, hydrogensulfid, ansvarlig for lukten av råtne egg
-NH3, ammoniakk, den gjennomtrengende aromaen som oppfattes i brukte såper
-Co2, Karbondioksid, en klimagass
-NEI2, nitrogendioksid
-Nei, nitrogenmonoksid, en gass som ble antatt ekstremt giftig, men spiller en viktig rolle i sirkulasjonssystemet
-SW3, Svoveltrioksid
-C4H10, butan
-HCl, hydrogenklorid
-ENTEN3, ozon
-Sf6, Hexafluoruro av svovel
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Egenskapene til gasser. Hentet fra: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Gass. Hentet fra: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (5. desember 2018). Gasser - Generelle egenskaper for gasser. Gjenopprettet fra: Thoughtco.com
- Harvard Men's Health Watch. (2019). Tilstanden av gass. Gjenopprettet fra: helse.Harvard.Edu
- Elektronikkkjølende redaktører. (1. september 1998). Den termiske konduktiviteten til gasser. Gjenopprettet fra: elektronisk-kjøling.com
- « Demonologihistorie, hvilken studie og berømte demonologer
- Grafiske nye egenskaper, elementer, eksempler »

