Gilbert Newton Lewis
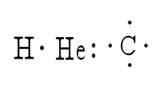
- 3946
- 1165
- Anders Mathisen
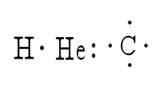 Gilbert Newton Lewis
Gilbert Newton Lewis Gilbert Newton Lewis (1875-1946) var en av de viktigste amerikanske forskerne i det tjuende århundre. Hans arbeid ga en strukturell revolusjon i kjemiske studier, takket være de flere bidragene han ga gjennom livet for utvikling av vitenskap.
Blant bidragene fra denne fysisk -kjemiske skiller seg ut formelen som bærer navnet hans, som elektronparene er grafisk representert. Lewis forskningsarbeid var veldig bredt, selv om hans berømmelse i utgangspunktet skyldtes teorien om kjemiske bindinger og definisjonen av syre-basisyre i 1923.
Lewis kom til å ha stor innflytelse på USAs vitenskapelige og akademiske verden, spesielt ved Harvard University, hvor styreleder ble dannet og diktert. Hans arbeid for den amerikanske hæren under første verdenskrig jeg fikk ham den største anerkjennelsen og den høyeste utmerkelsen.
Det ble dannet ved universitetene i Nebraska, Harvard, Leipzig og Gontinga i Tyskland. Han jobbet ved Massachusetts Institute (MIT), ved Harvard University og ved University of California, hvor han døde og jobbet.
Gjennom hele livet fikk han utallige anerkjennelser og priser, blant dem flere Honoris Doctorates of Chicago, Madrid, Liverpool, Wisconsin og Pennsylvania skiller seg ut. Han var æresmedlem i flere vitenskapelige institusjoner i England, India, Sverige, Danmark og USA.
Biografi
Fødsel og tidlige år
Gilbert Newton Lewis ble født i Weymouth, Massachusetts, 23. oktober 1875. Foreldrene hans var Frank Wesley Lewis og Mary Burr White Lewis. I løpet av de første årene fikk han læresetninger i sitt eget hjem, og klokka 10 gikk han inn på den offentlige skolen, hvor han ble uteksaminert i 1889.
I 1884 måtte Lewis bosette seg med familien i Lincoln, Nebraska. I en alder av 13 år ble han innlagt på videregående skole ved University of Nebraska.
Kan tjene deg: beryllium hydrid (Beh2)Studier
Da han ble uteksaminert, fortsatte han med universitetsstudiene sine i to år og deretter meldte seg inn ved Harvard University i 1893.
Opprinnelig var han interessert i økonomien, men valgte til slutt fysikk og kjemi. Gilbert fikk sin tittel i kjemi i 1896 og i et år underviste han på Phillips Academy, en privat skole for Andover.
Han kom tilbake til Harvard for å gjøre postgraduatejobben og skaffe mastergraden i 1898 med sin avhandling på Elektronet og et molekyl. Et år senere ble doktorgraden og oppgaven hans tittelen tittelen Noen elektrokjemiske og termokjemiske forhold til sink og kadmium amalgam"".
I Harvard tjente han som instruktør i et år, og reiste deretter til Europa med et stipend. Han studerte med datidens store fysikkjemikalier.
I 1899 reiste han til Tyskland for å studere med Wilhelm Ostwald Leipzig og deretter med Walter Nernst ved University of Gontinga; Så jobbet han for den filippinske regjeringen.
Akademisk arbeid og deltakelse i krig
Mellom 1999 og 1906 utstedte han en kjemibånd ved Harvard University og ble deretter ansatt av Massachusetts Institute of Technology, hvor han var fra 1907 til 1912.
Senere ble han professor i fysisk kjemi ved University of California (Berkeley), hvor han oppnådde graden av dekan ved School of Chemistry.
I 1908 publiserte han sin første artikkel om teorien om relativitet i parallellisme med Albert Einstein. I dette slår det fast at det er en kobling mellom energimasaen, men i en annen retning enn den som er ansatt av Einstein.
21. juni 1912 giftet Lewis seg med Mary Fankley Sheldon, som han hadde tre barn med: Margery S. Lewis, Edward s. Lewis og Richard Newton Lewis.
Det kan tjene deg: Giberélic Acid: Egenskaper, syntese, funksjonerHans arbeid i California ble avbrutt av utbruddet av første verdenskrig. I 1917 fikk han i oppdrag å jobbe for den amerikanske hæren, hvor han ble sjef for forsvarsdivisjonen for Chemical War Service.
Lewis levering og arbeidskapasitet tillot hæren. På slutten av krigen ble han tildelt sine tjenester med høyeste utmerkelser.
Død i laboratoriet
Gilbert n. Lewis døde i en alder av 70 for et hjerteinfarkt da han jobbet i laboratoriet sitt ved University of Berkeley, 23. mars 1946.
Kanskje på grunn av sin innadvendte personlighet, mottok denne fremtredende forskeren aldri Nobelprisen. Nesten på slutten av karrieren klarte han å bevise at fosforescensen av organiske molekyler styres av en spent tripletttilstand, til og med beregner dens magnetiske egenskaper.
Bidrag til vitenskap
Noen av Gilbert Newton Lewis viktigste bidrag til vitenskap er følgende:
Lewis strukturer
De er flere metoder som tjener til å representere strukturen til et molekyl. I disse representerer symbolene på elementene atomer, mens punktene representerer elektronene som omgir dem. Et eksempel på dette er representasjonen av hydrogen, helium og karbon:
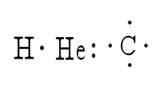
Lewis var den første som foreslo ideen om at atomer kunne forbli samlet ved å sammenligne elektronpar; Det er grunnen til at han skapte symbolikken i strukturene.
Den brede koblingsteorien foreslått av Lewis tjente til å gruppere i ett konsept Alle typer kjemiske koblinger. På denne måten ble forholdene mellom ioniske, molekylære, kovalente og metalliske stoffer demonstrert. Inntil da hadde disse elementene ikke hatt noen konseptuell forbindelse.
Kan tjene deg: type lenke på 02Kovalent binding
Konseptualisert den kovalente bindingen som dannes mellom to atomer når de blir med for å oppnå stabil oktett og dele elektroner på det siste nivået, bortsett fra hydrogen, som klarer å nå stabilitet ved å ha 2 elektroner.
Oktettteori
Det ble uttalt av Lewis i 1916. Dette slår fast at ionene som tilhører elementene i det periodiske systemet, har en tendens til å fullføre med et antall på 8 elektroner deres siste energinivå. Dette lar dem skaffe seg en veldig stabil konfigurasjon.
Photon
Det var skaperen i 1926 av begrepet foton for å utpeke den minste enheten av lysenergi. Denne energipartikkelen overfører alle eksisterende former for elektromagnetisk stråling (x -strays, infrarød, gamma, ultrafiolett, mikrobølger, radiobølger, etc.).
Kjemisk tiltrekning og Valencia
Sammen med sin kjemiske kollega Irwing Langmir utviklet han teorien om tiltrekning og kjemisk valens, som er kjent som Langmuir-Lewis teori. For dette var det basert på atomstrukturen til stoffer.
Tungt vann
Lewis var også den første forskeren som studerte og produserte tungt vann (deuterium) i sin reneste form. Han var også den første som brukte prinsippene for termodynamikk i studiet av kjemiske problemer.
Oppløsningsteori
På samme måte er Lewis anerkjent sitt arbeid om teorien om løsninger; Det vil si at de homogene blandinger oppnådd fra interposisjonen av atomer, molekyler eller ioner som er til stede i to eller flere stoffer. Disse stoffene som kalles komponenter griper inn i proporsjoner som varierer.

