Glykogenstruktur, syntese, nedbrytning, funksjoner
- 1345
- 316
- Magnus Sander Berntsen
Han Glykogen Det er lagringskarbohydratet til de fleste pattedyr. Karbohydrater kalles ofte sukker, og disse er klassifisert i henhold til antall avfall forårsaket av hydrolyse (monosakkarider, disakkarider, oligosakkarider og polysakkarider))).
Monosakkarider er de enkleste karbohydrater som er klassifisert i henhold til antall karbonatomer i deres struktur. Det er da Triosas (3C), Tetrosas (4C), Pentosas (5C), Hexosous (6C), Heptosase (7C) og Octosas (8C).
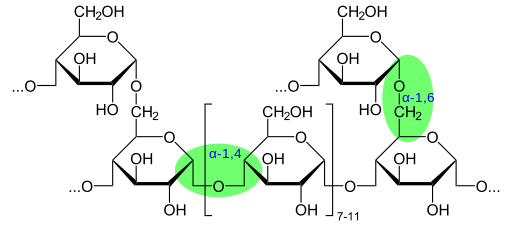
 Kjemisk glykogenstruktur som viser glykosidbindinger (kilde: glykogen.SVG: Neurotoger Derivat Work: Marek M [Public Domain] via Wikimedia Commons)
Kjemisk glykogenstruktur som viser glykosidbindinger (kilde: glykogen.SVG: Neurotoger Derivat Work: Marek M [Public Domain] via Wikimedia Commons) I henhold til tilstedeværelsen av aldehydgruppen eller Cetona -gruppen, er disse monosakkaridene også klassifisert som aldies eller ketosas.
Disakkarider gir opphav til hydrolyse, to enkle monosakkarider, mens oligosakkarider produserer 2 til 10 enheter monosakkarider og polysakkarider produserer mer enn 10 monosakkarider.
Glykogenet er, fra det biokjemiske synspunktet, et polysakkarid sammensatt av forgrenede kjeder av en seks -karbon aldose, det vil si en heksose kjent som glukose. Grafisk kan det være representert til glykogen som et glukosetre. Dette kalles også dyrestivelse.
Glukose i planter lagres som stivelse og i dyr som glykogen, som først og fremst lagres i lever- og muskelvevet.
I leveren kan glykogen etablere 10% av massen og 1% av muskelmasse. Som hos en 70 kg mann, veier leveren omtrent 1800 g og musklene omtrent 35 kg, er den totale mengden muskelglykogen mye større enn lever.
[TOC]
Struktur
Molekylvekten til glykogen kan nå 108 g/mol, tilsvarer 6 × 105 glukosemolekyler. Glykogen består av flere forgrenede a-D-glykosekjeder. Glukose (C6H12O6) er en aldohexosa som kan representeres på en lineær eller syklisk måte.
Glykogenet har en veldig forgrenet og kompakt struktur med kjeder på 12 til 14 glukoseavfall i form av α-D-glukose som er knyttet til α- (1 → 4) glukosidbindinger. Kjedeforgreninger dannes av α- (1 → 6) glukosidiske koblinger.
Glykogen, som stivelsen som er inntatt i kostholdet, gir de fleste karbohydrater som kroppen trenger. I tarmen blir disse polysakkaridene degradert ved hydrolyse og blir deretter absorbert mot sirkulasjonsstrømmen hovedsakelig som glukose.
Tre enzymer: ß-amylase, a-amylase og amylo-a- (1 → 6) -glukosidase er ansvarlige for tarmnedbrytning av både glykogen og stivelse.
A-amylasen hydrolyserer a-bindingene (1 → 4) tilfeldige i sidekjedene til både glykogen og stivelse, og får derfor navnet på endoglysidase. Ss-amyla er en eksoglikosidase som slipper ß-maltose dímeros som bryter α- (1 → 4) glykosidiske koblinger fra endene av de ytterste kjedene uten å nå konsekvensene.
Med tanke på det faktum at verken ß-amylase eller a-amylase nedbryter grener, er sluttproduktet av dens handling en svært forgrenet struktur på omtrent 35 til 40 glukoserester som kalles grensen dextrin.
Grensen dekstrin hydrolyseres endelig på grenpunktene som har α- (1 → 6) bindinger gjennom amyle-a- (1 → 6) -glukosidase, også kjent som "ærekrenkende" enzym. Kjedene frigitt av denne defloaten blir etter degradert av ß-amylase og a-amylase.
Når det inntatt glykogenet kommer inn som glukose, må den som finnes i vevene syntetiseres av organismen fra glukose.
Kan tjene deg: puriner: egenskaper, struktur, funksjonerSyntese
Glykogensyntese kalles glykogenese og foregår spesielt i muskelen og leveren. Glukosen som kommer inn i organismen med kostholdet, overfører den sirkulasjonsstrømmen og derfra inne i cellene, hvor den umiddelbart fosforyleres av et enzym kalt glycoquinase.
Glucoquinase fosforyyl til glukose i karbon 6. ATP gir fosfor og energi for denne reaksjonen. Som et resultat dannes glukose 6-fosfat og en ADP frigjøres. Deretter blir 6-fosfat glukose glukose 1-fosfat ved virkningen av en fosfoglukomutase som gjørmer fosfor fra posisjon 6 til posisjon 1.
1-fosfatglukosen aktiveres for glykogensyntese, noe som innebærer deltakelse av et sett med tre andre enzymer: UDP-glycose pyrofosforylase, syntetisk glykogen og ammilo- (1,4 → 1,6) -glikosyltransferase.
Glukose-1-fosfat, sammen med trifosfat uridin (UTP, et nukleosid av uridintrifosfat) og ved handling av UDP-glykose-pyrofosforylase, danner difosfat-glukose uridinkompleks (UDP GLC) (UDP Glc). I prosessen er et pyrofosfation hydrolysert.
Deretter danner det syntetiske glykogenenzymet en glukosidbinding mellom C1 i UDP GLC -komplekset og C4 for en glykogenglukoseterminalrest, og UDP UDP frigjøres fra UDP -aktivert glukosekompleks. For at denne reaksjonen skal oppstå, må det være et eksisterende glykogenmolekyl kalt "primær glykogen".
Det primordiale glykogenet syntetiseres på et grunningsprotein, glykogenin, som har 37 kDa og glysila i en tyrosinrest ved bruk av UDP GLC -komplekset. Derfra er de koblet α-D-glukoseavfall med 1 → 4 lenker og en liten kjede dannes som synthesase glykogen virker.
Når de innledende kjedene kobler minst 11 glukoserester, overfører forgreningen eller Amile -enzymet- (1,4 → 1,6) -glikosyltransferase et kjedestykke på 6 eller 7 glukoseavfall til den tilstøtende kjeden i posisjon 1 → 6, som etablerer en gren punkt. Glykogenmolekylet som således er bygget, vokser ved tilsetning av glukoseenheter med glykosidkoblinger 1 → 4 og flere forgreninger.
Nedbrytning
Glykogen -nedbrytning kalles glukogenolyse, og tilsvarer ikke den motsatte banen til syntesen. Hastigheten på denne ruten er begrenset av hastigheten på reaksjonen katalysert av fosforylasegykogenet.
Fosforyllase glykogen er ansvarlig for splitting (fosforolyse) av koblinger 1 → 4 fra glykogenkjeder, frigjør glukose 1-fosfat. Den enzymatiske handlingen begynner i endene av de ytterste kjedene og fjernes sekvensielt til 4 glukoserester forblir på hver side av konsekvensene.
Deretter forlater et annet enzym, a- (1 → 4) → α- (1 → 4) glukano transferas, grenpunktet utsatt ved å overføre en trisakkaridenhet fra en gren til en annen. Dette tillater Amilo- (1 → 6) -Glukosidase (Urampisk enzym) Hydrolys. Den kombinerte virkningen av disse enzymene ender fullstendig splitting til glykogen.
Ettersom den første reaksjonen av fosfomutase er reversibel, kan 6-fosfat glukose dannes fra glukoserester 1-fosfat splittet fra glykogen. I leveren og nyre, men ikke i muskelen, er det et enzym, glukose-6-fosfatase, som er i stand til å samle seg til 6-fosfat glukose og gjøre den til gratis glukose.
Kan tjene deg: FotolyseDefosforylert glukose kan spre seg til blod, og det er slik leverglykogenolyse gjenspeiles i en økning i blodsukkerverdiene (glykemi).
Regulering av syntese og nedbrytning
Av syntese
Denne prosessen utøves på to grunnleggende enzymer: synthesase glykogen og fosforylase glykogen, slik at når den ene av dem er aktivert, er den andre i sin inaktive tilstand. Denne forskriften forhindrer motstandere av syntese og nedbrytning av reaksjoner og nedbrytning samtidig.
Den aktive formen og inaktive formen for begge enzymer er veldig forskjellig, og interkonversjonen av de aktive og inaktive formene av fosforylase og syntetisk glykogen er utsatt for streng hormonell kontroll.
Adrenalin er et hormon som frigjøres fra binyremargen, og glukagon er en annen som oppstår i den endokrine delen av bukspyttkjertelen. Endokrin bukspyttkjertel produserer insulin og glukagon. Langerhans holmer α er de som syntetiserer glukagon.
Adrenalin og glukagon er to hormoner som frigjøres når energi er nødvendig som respons på reduksjonen i blodsukkernivået. Disse hormonene stimulerer aktivering av fosforylasegykogen og hemmer synthesase glykogen, og stimulerer dermed glykogenolyse og hemmer glykogenese.
Mens adrenalin utøver sin virkning på muskler og lever, virker glukagon bare på leveren. Disse hormonene er forbundet med spesifikke membranreseptorer i den hvite cellen, som aktiverer cyclasa adeniler.
Aktiveringen av cyklase -adenylatet begynner en enzymatisk foss som på den ene siden aktiverer en AMPC -avhengig proteinquinase som er inaktiv til syntetisk glykogen og aktiverer glykogenfosforylase ved fosforylering (direkte og indirekte).
Skjelettmuskelen har en annen mekanisme for aktivering av fosforylasegykogen gjennom kalsium, som frigjøres som en konsekvens av depolarisering av muskelmembranen i begynnelsen av sammentrekningen.
Av nedbrytning
Enzymatiske fossefall beskrevet ovenfor ender opp med å øke glukosenivået, og når de når et visst nivå, blir glykogenese aktivert og glukogenolyse blir hemmet, og hemmer også den videre frigjøring av adrenalin og glukagon.
Glykogenese aktiveres ved aktivering av fosfatase fosforylase, et enzym som regulerer glykogensyntese ved flere mekanismer, som innebærer inaktivering av kinase fosforylase og fosforylase α, som er en synthesase glykogeninhibitor.
Insulin fremmer inntreden av glukose i muskelceller, og øker 6-fosfat glukosenivåer, som stimulerer defosforylering og aktivering av synthesase glykogen. Dermed begynner syntese og glykogen -nedbrytning blir hemmet.
Funksjoner
Muskelglykogen utgjør en energireserve for muskelen som, i likhet med reservefett, lar muskler oppfylle sine funksjoner. Å være en glukosekilde, brukes muskelglykogen under trening. Disse reservasjonene øker med fysisk trening.
I leveren utgjør glykogen også en viktig reservekilde for både organets funksjoner og for glukoseens bidrag til resten av kroppen.
Denne funksjonen til leverglykogen skyldes det faktum at leveren inneholder 6-fosfatase glukose, et enzym som er i stand til å eliminere 6-fosfatglukosefosfatgruppen og gjøre den til fri glukose. Gratis glukose, i motsetning til fosforylert glukose, kan spres gjennom hepatocyttmembranen (leverceller).
Det kan tjene deg: Sporulering: I planter, i sopp og i bakterierSlik kan leveren gi glukose til sirkulasjon og opprettholde stabile glukosenivåer, selv i langvarige fasteforhold.
Denne funksjonen er av stor betydning, siden hjernen næres nesten utelukkende fra blodsukker, så alvorlig hypoglykemi (veldig lavt blodsukkerkonsentrasjoner) kan forårsake kunnskapstap.
Relaterte sykdommer
Glykogenrelaterte sykdommer får det generiske navnet "Glykogenlagringssykdommer".
Disse sykdommene utgjør en gruppe arvelige patologier som er preget av avsetningen i vevene i unormale mengder eller typer glykogen.
De fleste glykogenlagringssykdommer er forårsaket av et genetisk karakterunderskudd av noen av enzymene som er involvert i glykogenmetabolisme.
De er klassifisert i åtte typer, hvorav de fleste har sine egne navn, og hver av dem er produsert av et annet enzymatisk underskudd. Noen er dødelige i veldig tidlige stadier av livet, mens andre er ledsaget av muskelsvakhet og underskudd under trening.
Enestående eksempler
Noen av de mest fremtredende glykogenrelaterte sykdommene er følgende:
- Von Gierkes sykdom eller glykogenlagringssykdom av type I, produseres av et 6-fosfatase glukoseunderskudd i lever og nyre.
Det er preget av unormal levervekst (hepatomegali) på grunn av den overdrevne akkumuleringen av glykogen og hypoglykemi, siden leveren ikke kan gi glukose til sirkulasjon. Pasienter med denne tilstanden har vekstendringer.
- Pompe eller type II sykdom skyldes et α-underskudd (1 → 4) -glukano 6-glykosyltransferaer i lever-, hjerte- og skjelettmusklene. Denne sykdommen, som Andersen eller type IV, er dødelig før de to leveårene.
- McArdle eller type V sykdom har et muskelfosforylaseunderskudd og er ledsaget av muskelsvakhet, redusert treningstoleranse, unormal akkumulering av muskelsglykogen og fravær av laktat under trening under trening.
Referanser
- Bhattacharya, k. (2015). Undersøkelse og håndtering av leverens glykogenlagringssykdommer. Translasjonspediatri, 4(3), 240-248.
- Dagli, a., Sentner, c., & Weinstein, D. (2016). Glykogenlagringssykdom type III. Genanmeldelser, 1-16.
- Guyton, a., & Hall, J. (2006). Lærebok for medisinsk fysiologi (11. utg.). Elsevier Inc.
- Mathews, c., Van Holde, K., & Ahern, K. (2000). Biokjemi (3. utg.). San Francisco, California: Pearson.
- McKiernan, p. (2017). Patobiologi av leverens glykogenlagrings ønske. Curr Pathobiol Rep.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, P. (2009). Harpers illustrerte biokjemi (28. utg.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Lehninger prinsipper for biokjemi. Omega -utgaver (5. utg.).
- Rawn, J. D. (1998). Biokjemi. Burlington, Massachusetts: Neil Patterson Publisher.
- TARNOPOLSKY, m. TIL. (2018). Myopatier relatert til glykogenmetabolismeforstyrrelser. Nevroterapeutika.
- « Argonhistorie, struktur, egenskaper, bruker
- Bijektive funksjon Hva er, hvordan gjøres det, eksempler, øvelser »

