Hexano (C6H14) Fysiske og kjemiske egenskaper, struktur, bruk, toksisitet
- 4970
- 406
- Marius Aasen
Han heksan Det er et hydrokarbon som er preget av å være en organisk forbindelse med kondensert kjemisk formel C er6H14. Det er en fargeløs, gjennomsiktig væske, som ikke kan blandes med vann. Det presenterer fem isomerer, det lineære er en av de viktigste parafiniske hydrokarbonene i bransjen og forskningen.
Heksan oppnås ved fraksjonert destillasjon av råolje. Det er også naturlig til stede i sitrusfrukter og flyktige fraksjoner av forskjellige planter eller frukt som eple, guava, stekt hasselnøtter, søtpotet og salvie.
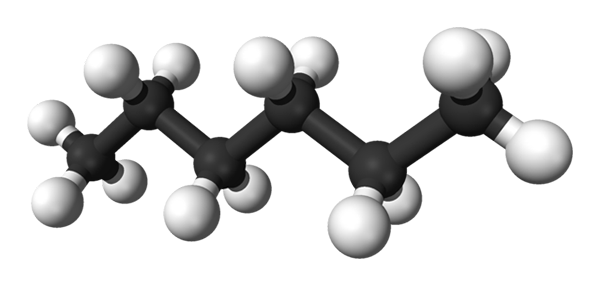
 N-heksanmolekyl. Kilde: Benjah-BMM27 [Public Domain]
N-heksanmolekyl. Kilde: Benjah-BMM27 [Public Domain] Det er en veldig brennbar flyktig væske som finnes i bensin, raskt tørkende lim og i å gni sement. Heksan brukes som et løsningsmiddel i prosessen med ekstraksjon av vegetabilske oljer, samt lipider og fett til stede i forurenset vann og jordsmonn.
Mennesker som er profesjonelt utsatt for Hexano, kan oppleve skade på det perifere nervesystemet, manifestert av prikking og ben i bena og armene; I tillegg til generalisert muskelsvakhet og i alvorlige tilfeller, atrofi av skjelettmusklene.
[TOC]
Fysiske og kjemiske egenskaper til heksaner
Fysisk utseende
Fargeløs, gjennomsiktig og veldig flyktig væske.
Molmasse
86,178 g/mol
Lukt
Bensin lignende
Lukt terskel
1,5 ppm
Tetthet
0,6606 g/ml
Smeltepunkt
-96 til -94 ºC
Kokepunkt
68,5 til 69,1 ºC
tenningspunkt
-22 ºC (lukket kopp).
Vannløselighet
9,5 mg/l (praktisk talt uønsket med vann)
Løselighet i løsningsmidler
Veldig løselig i etanol, oppløselig i etyleter og kloroform. Blandelig med alkohol, kloroform og eter.
Relativ tetthet av damp med luft
2.97 (luft = 1)
Oktanol/vannpartisjonskoeffisient
Logg P = 3 764
Damptrykk
17,60 kPa ved 20 ºC
Bølgelengde av maksimal optisk tetthet
200 nm
Det kan tjene deg: Niobio (NB): Struktur, egenskaper, bruk, skaffelseBrytningsindeks
1.375
Goo
0,3 MPa · s
Kalorikapasitet
265.2 J · K-1· Mol-1
Forbrenningsvarme
4.163,2 kJ · mol-1
Fordampningsvarme
31,56 kJ · mol-1
Overflatespenning
17,89 mn/m a 25 ºC
Ioniseringspotensial
10,18 EV
Stabilitet
Stabil. Uforenlig med oksidasjonsmidler, klor, fluor, magnesium perklorat. Danner en eksplosiv blanding med luften.
Reaktivitet
Heksan kan reagere kraftig med oksidasjonsmaterialer, som kan omfatte flytende klor, konsentrert oksygen, natriumhypokloritt og kalsiumhypokloritt. Det er også uforenlig med dyitrogentroksyd. Heksan kan angripe noen former for plast, gummi og belegg.
Heksanstruktur
Intermolekylære interaksjoner
Det første bildet viser molekylet til n-Heksan representert av en modell av sfærer og barer. De svarte kulene tilsvarer karbonatomer, som komponerer det sikksagging karbonskjelettet, mens de hvite kulene er hydrogenatomer. Han n-Hexano er derfor en hydrokarbon, lineær og svært dynamisk.
Fordi alle C-H-koblingene er lav polaritet, mangler molekylet dipolmomentet. Ved å gjøre dette er det ikke de intermolekylære interaksjonene til dipol-dipol.
Hvert molekyl av n-Hexano "passer" en på toppen av den andre ved veldig lave temperaturer, som det antas i sin krystallinske struktur. På den annen side, i væsken, bøyer skjelettene sine og roterer C-H-bindingene sine, med opprinnelse om at nevnte væske er flyktig og koker ved 68,7 ºC.
Isomerer
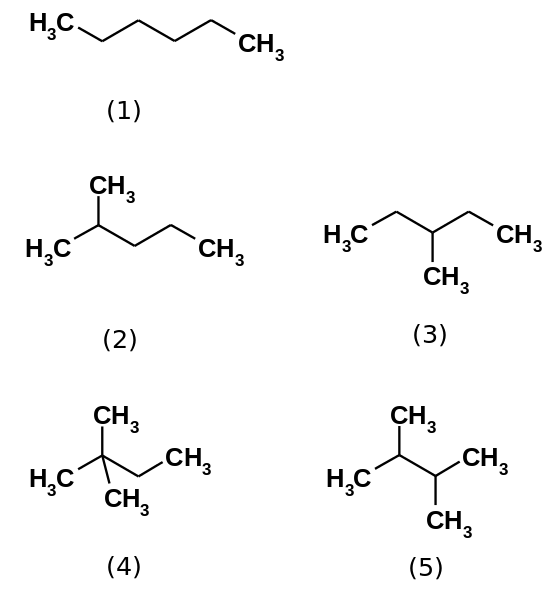 De fem heksanisomerer. Kilde: Steffen 962 [Public Domain]
De fem heksanisomerer. Kilde: Steffen 962 [Public Domain] Heksanhydrokarbon består faktisk av fem isomerer, og er den n-Heksan den minst forgrenede, (1). De fire andre isomerer er, i økende rekkefølge:
2-metylpropan (2)
3-metylpropan (3)
2,2-dimetylbutan (4)
2,3-dimetylbutan (5)
Merk at strukturene blir mer forgrenet fra (1) til (5). Å være mer forgrenede, spredende krefter avtar, fordi det ikke lenger er lineære porsjoner som leges effektivt. Dette fører til en reduksjon og variasjon av isomers kokepunkter; Selv om visse akseptable avvik er observert.
Kan tjene deg: hva er erristeneo?Begge 2-metylpropanen. Deretter blir den fulgt av 2,3-dimetylbutan (PEB = 58 ºC), for endelig å plassere 2,2-dimetylbutan som den mest flyktige væsken (PEB = 49,7 ºC).
applikasjoner
Heksan er blandet med lignende kjemikalier for å produsere løsningsmidler. Blant navnene som disse løsningsmidlene får er kommersiell heksan, blandede heksaner, etc. De brukes som rengjøringsmidler i tekstilindustrien, møbler og hul utskrift.
Heksan er en ingrediens i limet som brukes i vanntetting av tak, i fottøy og lær. Det brukes også til å binde bøker, for å få piller og tabletter, skylle, lage dekk og baseballkuler.
Heksan brukes til å bestemme mineralfraksjonsindeksen og fyllingsvæske for termometrene i stedet for kvikksølv; Generelt med et rødt eller blått fargestoff. Det brukes også i ekstraksjon av fett og vannolje for analyse av forurensninger.
Hexano brukes som et løsningsmiddel i ekstraksjon av plantefrøolje, for eksempel soyabønner, raps eller bit. I tillegg brukes den til å avfalle deler av forskjellige opprinnelser. Det brukes i alkohol denaturering, i HPLC -analysemetoden og spektrofotometri.
Toksisitet
Innånding og kontakt
Den akutte toksisiteten til heksan er relativt lav, selv om det er en mild anestesi. Akutt eksponering for høye heksankonsentrasjoner kan produsere ved innånding, mild depresjon av sentralnervesystemet (CNS), som manifesteres av svimmelhet, svimmelhet, mild kvalme og hodepine.
Kan tjene deg: endotermisk reaksjonDet kan også forårsake dermatitt og irritasjon av øynene og halsen. Kronisk heksaninhalering, relatert til arbeidsaktivitet, kan forårsake skade på det perifere nervesystemet (sensomotorisk polyneuropati).
Opprinnelige symptomer er prikking og benkramper og armer, etterfulgt av muskelsvakhet. I alvorlige tilfeller kan det være en atrofi av skjelettmuskler, sammen med tap av koordinering og synsproblemer.
Heksan toksisitet er relatert til generering av heksan-2,5-diona metabolitt. Dette reagerer med aminosyrelysinet til en protein lateral kjede, og produserer tap av proteinfunksjon.
Sikker dose
Enviromental Protection Agency (EPA) beregnet en referansekonsentrasjon (RFC) for 0,2 mg/m heksan3, og en referansedose (RFD) på 0,06 mg/kg vekt/dag.
På 1960- og 1970 -tallet er tilstedeværelsen av nerveforandringer. Årsaken var at de pustet inn en atmosfære av heksan på 500 - 2.500 ppm, i 8-14 timer per dag.
Arbeiderne presenterte de kjente symptomene på kronisk innånding av Hexano, og oppdaget legene at nervene som kontrollerte musklene i armene og bena ble skadet.
Referanser
- Danielle Reid. (2019). Heksan: Struktur, formel og egenskaper. Studere. Gjenopprettet fra: Studie.com
- Nasjonalt senter for bioteknologiinformasjon. (2019). Heksan. PubChem -database. CID = 8058. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Heksan. Hentet fra: i.Wikipedia.org
- Verden av molekyler. (s.F.). Heksanmolekyl. Gjenopprettet fra: WorldOfmolekyler.com
- Kjemisk bok. (2017). Heksan. Gjenopprettet fra: ChemicalBook.com
- Commonwealth of Australia. (s.F.). N-HEXANE: Kilder til utstedelser. Gjenopprettet fra: NPI.Gov.Au
- EPA. (2000). Heksan. [PDF]. Gjenopprettet fra: EPA.Gov
- Byrå for giftige stoffer og sykdomsregister. (1999). Pub Pub Health Statement for N-Hexan. Hentet fra: ATSDR.CDC.Gov
- « 5 kjemiske reaksjoner eksperimenter (enkel og trygg)
- Toronjil -egenskaper, habitat, egenskaper, dyrking, omsorg »

