Kjemisk hybridisering

- 1705
- 192
- Daniel Skuterud
Hva er kjemisk hybridisering?
De Kjemisk hybridisering Det er "blandingen" av atomiske orbitaler, hvis konsept ble introdusert av kjemikeren Linus Pauling i 1931 for å dekke ufullkommenhetene i Valencias Link Theory (TEV). Hvilke ufullkommenheter? Disse er: molekylære geometrier og ekvivalente koblinger i molekyler som metan (CH4).
I følge TEV danner de atomiske orbitaler i C fire σ -koblinger med fire H -atomer. Orbitalene 2p, med former av ∞ (nedre bilde) av C er vinkelrett på hverandre, så H bør fjernes fra hverandre i en vinkel på 90º.

I tillegg er de 2s (sfæriske) orbitalene. Eksperimentelt har det imidlertid blitt funnet at vinklene i CH4 De er 109,5º og at i tillegg er lengdene på C-H-koblingene likeverdige.
For å forklare dette, må en kombinasjon av originale atombaner anses å danne fire degenererte hybrid orbitaler (med lik energi). Her spiller kjemisk hybridisering. Hvordan er hybrid orbitaler? Det avhenger av atombanene som genererer dem. De viser også en blanding av de elektroniske egenskapene til disse.
Sp3
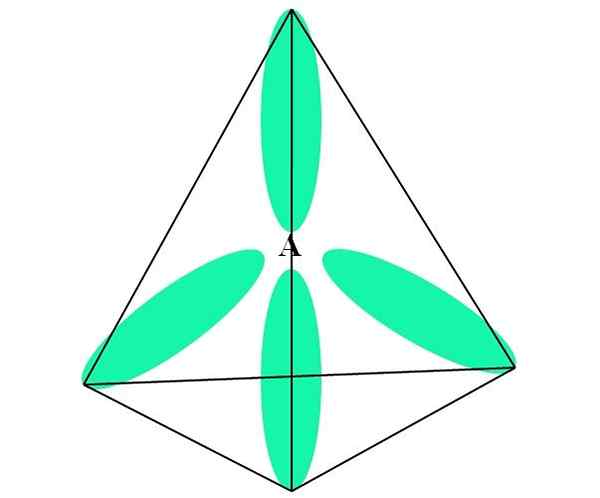
I tilfelle av CH4, C Hybridisering er SP3. Fra denne tilnærmingen blir molekylær geometri forklart med fire SP -orbitaler3 atskilt ved 109,5º og peker mot toppunktene til en tetrahedron.
I det øvre bildet kan du se hvordan orbitalene sp3 (grønn) Etabler et tetrahedrisk elektronisk miljø rundt atomet (A, som er C for CH4).
Kan tjene deg: aminerHvorfor 109,5º og ikke andre vinkler, for å "tegne" en annen geometri? Årsaken skyldes at denne vinkelen minimerer de elektroniske frastøttene til de fire atomene som er knyttet til.
På denne måten er Cho's molekyl4 Det kan bli representert som en tetrahedron (tetrahedral molekylær geometri).
Hvis C, i stedet for H, dannet C -koblinger med andre atomer av atomer, hva ville dens hybridisering da være? Forutsatt at karbon danner fire koblinger σ (c-a), vil hybridiseringen være SP3.
Det kan konsekvent antas at i andre organiske forbindelser som CH3Å, CCL4, C (kap3)4, C6H12 (Cyclohexan), etc., Karbon har en SP -hybridisering3.
Dette er viktig for å tegne organiske strukturer, der karbonatomer med enkle koblinger representerer divergenspunkter; det vil si at strukturen ikke forblir i et enkelt plan.
Tolkning
Hva er den enkleste tolkningen for disse hybride orbitalene uten å adressere matematiske aspekter (bølgefunksjoner)? Orbitalene sp3 De antyder at de stammer fra fire orbitaler: en og tre s.
Fordi kombinasjonen av disse atombanene er ment å være ideell, er de fire SP -orbitalene3 resulterende er identiske og okkuperer forskjellige orienteringer i verdensrommet (for eksempel i orbitalene px, pog Og sz).
Ovennevnte er aktuelt for resten av de mulige hybridasjonene: antallet hybridbaner som dannes er det samme som det atomiske orbitalene som kombineres. For eksempel sp híbridos orbital3d2 De er dannet fra seks atombaner: en S, tre P og to d.
Avvik fra koblingsvinkler
I henhold til frastøtningsteorien om elektroniske par av Valencia -laget (RPECV), opptar et par gratis elektroner mer volum enn et koblet atom. Dette fører til at koblingene beveger seg bort, reduserer elektronisk spenning og avleder vinklene på 109,5º:
Det kan tjene deg: Cruise for Crucible: Egenskaper, funksjoner, bruk eksempler
For eksempel i vannmolekylet er atomene til H knyttet til orbitalene SP3 (i grønt), og også parene med elektroner som ikke er delt ":" Okkupere disse orbitalene.
Repulsionene av disse elektronparene er vanligvis representert som "to ballonger med øyne", som på grunn av deres volum frastøter de to koblingene σ o-H.
I vannet er således vinklene på koblinger virkelig 105º, i stedet for 109,5º forventet for tetrahedral geometri.
Hvilken geometri har H da har2ENTEN? Har en vinkelgeometri. Fordi? For mens elektronisk geometri er tetrahedral, forvrenger to par ikke delte elektroner den til en vinkelmolekylær geometri.
Sp2
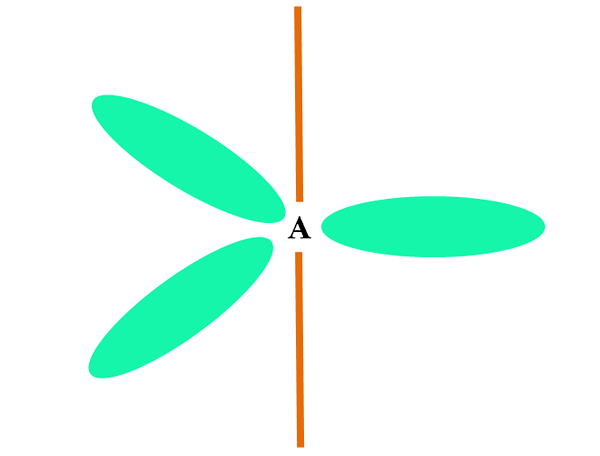
Når et atom kombinerer to eller s orbitaler, genererer det tre hybrid orbitaler sp2; Imidlertid forblir en orbital P (fordi det er tre) uendret, som er representert som en oransje bar i det øvre bildet.
Her, de tre orbitalene SP2 De er grønne for å fremheve forskjellen fra den oransje baren: orbital P "Pure".
Et atom med SP -hybridisering2 Det kan visualiseres som et trigonal flat gulv (trekanten trukket med SP -orbitalene2 grønt), med sine hjørner adskilt med 120 º vinkler og vinkelrett på en stolpe.
Og hvilken rolle spiller orbital rene rent? Å danne en dobbel binding (=). Orbitalene sp2 De tillater dannelse av tre koblinger σ, mens orbital rene P -bindingen π (en dobbel eller trippelkobling involverer en eller to koblinger π).
For eksempel å tegne karbonylgruppen og strukturen til formaldehydmolekylet (h2C = o), fortsetter det som følger:
Det kan tjene deg: Cycopropane (C3H6)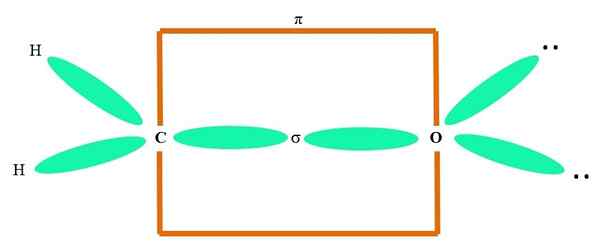
Orbitalene sp2 Både C og O -danner en kobling σ, mens dens rene orbitaler danner en π -binding (det oransje rektangelet).
Det kan legges merke til hvordan resten av de elektroniske gruppene (H -atomer og parene til ikke delte elektroner) er lokalisert i de andre SP -orbitalene2, atskilt med 120º.
Sp
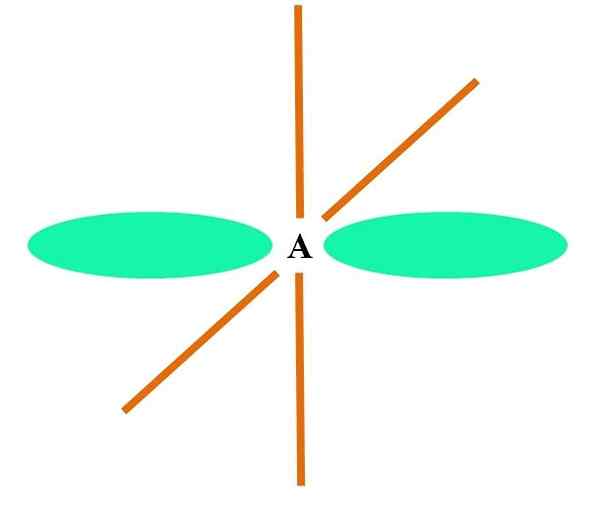
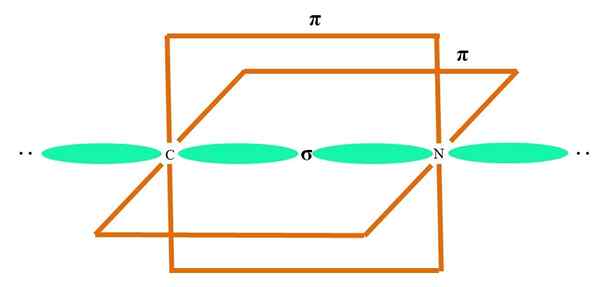
I det overlegne bildet er et atom illustrert med SP -hybridisering. Her, en orbital s og en orbital P. Imidlertid er to rene orbitale orbitaler nå uendret, som lar dem danne to doble lenker eller en trippelkobling (≡).
Med andre ord: Hvis i en struktur en C overholder ovennevnte (= C = O C≡C), er hybridiseringen SP SP, SP. For andre mindre illustrerende atomer - som overgangsmetaller - er beskrivelsen av elektroniske og molekylære geometrier komplisert fordi orbitalene d og til og med F også blir vurdert.
Hybrid orbitaler skilles i en vinkel på 180º. Av denne grunn er de koblede atomene anordnet i en lineær molekylær geometri (B-A-B). Til slutt, i det nedre bildet, kan cyanidanionstrukturen sees: