Umettede hydrokarboner
- 2165
- 530
- Daniel Skuterud
Vi forklarer hva umettede hydrokarboner, deres klassifisering, egenskaper, nomenklatur og gir flere eksempler er
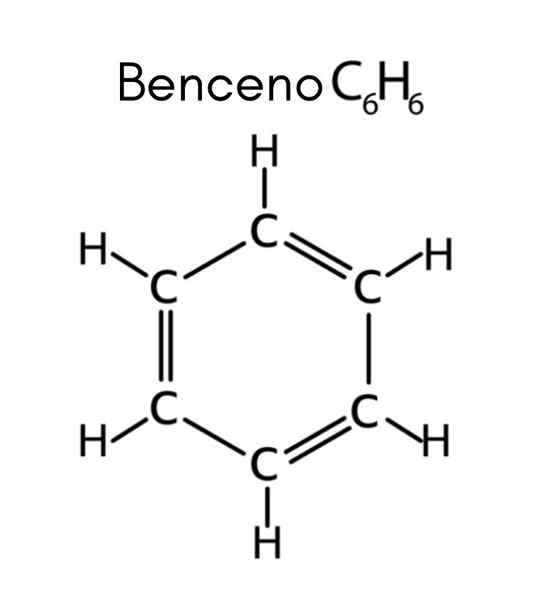
 Benzen er et eksempel på umettet hydrokarbon
Benzen er et eksempel på umettet hydrokarbon Hva er umettede hydrokarboner?
De umettede hydrokarboner De er organiske forbindelser som bare dannes av karbon og hydrogen, som har en eller flere flere bindinger mellom karbonatomer. Dette betyr at enhver formel C -forbindelsexHog som presenterer en dobbel eller en trippelbinding er et umettet hydrokarbon.
Umettede hydrokarboner dannes av alkener og alkiner, så vel som aromatiske forbindelser. Årsaken til at de er umettet er fordi de har et mindre antall hydrogener enn det maksimale de kunne ha, gitt antall karbonatomer i strukturen.
Umettede hydrokarboner gjenkjennes ved å ha mindre enn 2n+2 hydrogener (som er det maksimale antallet hydrogener som kan være karbon), hvor N er antallet karbonatomer i molekylformelen.
Et eksempel på umettet hydrokarbon er Buteno, hvis molekylære formel er C4H8. Maksimalt antall hydrogener for 4 karbonatomer ville være 2 (4) +2 = 10 hydrogener. Dette tilsvarer antall hydrogener av et mettet hydrokarbon. Ettersom Buteno bare har 8 hydrogener, som er mindre enn 10, er det et umettet hydrokarbon.
Antall umettethet
Umettede hydrokarboner er preget av antall umettethet. Dette indikerer antall hydrogenpar mindre enn et umettet hydrokarbon sammenlignes med en mettet en som har samme antall karbonatomer.
Antall umettethet kan beregnes for enhver umettet forbindelse ved hjelp av følgende formel:
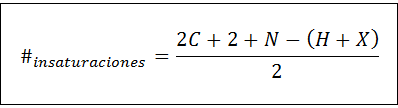
Hvor C, N, H og X representerer antall karbonatomer, nitrogener, hydrogener og halogener i molekylformelen. Dette tallet gir oss en ide om hvor mange dobler eller trippelbindinger som har en forbindelse, gitt sin molekylære formel, selv om det må tas forsiktighet fordi sykluser (som ikke er umettet) også bidrar til antall umettethet:

Eksempel
Benzen har formel C6H6, Så antall umettethet er:
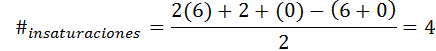
I dette tilfellet tilsvarer de 4 umettheten til tre doble lenker og en syklus.
Klassifisering av umettede hydrokarboner
I henhold til typen hydrokarbon
- Alkener: De er de som har minst en dobbeltkobling i strukturen sin.
- Alkynes: De er de som har minst en trippelkobling i strukturen.
- Aromatisk: De er sykliske flerumettede forbindelser med spesielle egenskaper som gjør dem spesielt stabile.
I følge karbonkjeden
- Lineær: umettede forbindelser der alle karbonatomer er knyttet til hverandre i en enkelt kjede.
- GRAFT: De er de som har en hovedkjede og også flere laterale kjeder som danner konsekvenser.
- Syklisk: De er de der det presenteres en lukket syklus av karbonatomer der minst en dobbel eller trippelbinding presenteres (Cycloalquenos, Cycloalquino og aromatisk).
I henhold til antall umettethet
- Enumettet: Når de bare har en flere lenker, det vil si at det er en enkelt dobbeltbinding eller en enkelt trippelkobling.
- Polynsettet: Når strukturen har mer enn en multiple lenke, som i tilfelle av alkian, alkian, alkeniner, etc.
Egenskaper til umettede hydrokarboner
Egenskapene til umettede hydrokarboner avhenger sterkt av den aktuelle typen hydrokarbon:
Fusjons- og kokepunkter
Generelt sett har umettede hydrokarboner lave fusjons- og kokepunkter. Sammenlignet med alkaner har alkener med samme antall karbonatomer og lignende hovedkjede vanligvis et lavere kokepunkt, mens alkiner har en tendens til å ha større kokepunkter.
Det samme gjelder fusjonspunkter. I tabellen nedenfor kan det sees at både fusjonspunktet og kokingen av 1-pentener er lavere enn pentanen og disse at de av 1-pentino.

Fysisk tilstand
På grunn av sine lave smelte- og kokepunkter, har umettet lav molekylær vekthydrokarboner en tendens til å være gassformig ved romtemperatur. Mange er også flytende og de med større molekylvekt er faste. I mange tilfeller er faste stoffer amorfe faste stoffer i stedet for krystallinsk.
Polaritet
Alle hydrokarboner, inkludert umettet, er apolare forbindelser, fordi karbonelektronegativitet og hydrogen er veldig like. Det eneste unntaket er i tilfelle av terminale alkiner2 og sp3.
Løselighet
Å være apolare, umettede hydrokarboner er uoppløselige i vann og andre polare løsningsmidler, men de er veldig oppløselige i apolare løsningsmidler som karbontetraklorid, cyclohexan og andre. Faktisk er mange av disse forbindelsene i seg selv apolare løsningsmidler.
Det kan tjene deg: disposio: struktur, egenskaper, innhenting, brukDe er drivstoff
Et kjennetegn ved alle hydrokarboner, inkludert umettet, er at de brenner i nærvær av oksygen for å bli karbondioksid og vann som frigjør energi i form av lys og varme.
De kan polymerisere
Gjennom forskjellige kjemiske reaksjoner kan alkener og alkiner bli sammen med hverandre for å danne polymerer som i tilfelle av polyetylen og polypropylen, for bare å nevne noen. Så umettede hydrokarboner er startmaterialet til mange vanlige plast.
Kjemisk reaktivitet
Reaktiviteten avhenger sterkt av den type funksjonelle gruppen som har et molekyl. Når det.
På den annen side er aromatiske forbindelser vanligvis ganske inerte fordi de er veldig stabile. De karakteristiske reaksjonene til disse forbindelsene er de aromatiske elektrofile substitusjonsreaksjonene.
Nomenklatur av umettede hydrokarboner
Nomenklatur av alkener
Lineære alkener
Navnet på de lineære alkenene er bygget ved å plassere et prefiks som indikerer antall karbonatomer i kjeden, etterfulgt av karbonlokatoren der den separate dobbeltbindingen begynner med skript fra resten av navnet og avsluttet med suffikset _eno:
Prefiks-lokaliserer
- Eksempel:
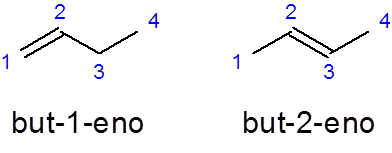
Han Men -1 -nei Det er navnet på den lineære buten med en dobbeltbinding i det første karbonet mens Men-2-ni Den har dobbeltbindingen i det andre karbonet.
Forgrenede alkener
Når det. Navnet bygges først ved å plassere konsekvensene i alfabetisk rekkefølge foran av dens lokalatorer etterfulgt av navnet på hovedkjeden som angitt ovenfor.
- Eksempel:
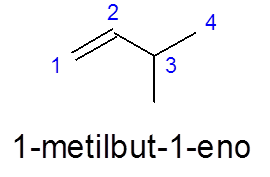
I 3-metylbut-1 -en blir nummereringen gjort fra venstre til høyre for å prioritere dobbeltbindingen, i stedet for å prioritere forgrening (metylgruppen).
Polyener
Når det.
I navnet på hovedkjeden legges en lokaliserende for hver dobbeltbinding og prefikset di, tri, tetra, etc. Før avslutningen -eno, for å indikere antall doble lenker du har.
- Eksempel:
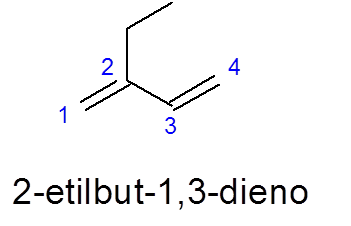
Legg merke til i dette tilfellet at til tross for at det er en lengre 5 -karbonkjede, er 4 av 4 valgt, siden den inneholder de to dobbeltkoblingene.
Nomenklatur av Alquinos
Alkynene er kalt veldig lik Alkenes, med den eneste forskjellen som navnet ender i -INO i stedet for -eno. I tilfeller der det er mer enn en trippelkobling, plasseres lokatorene av dem alle og det numeriske prefikset som indikerer hvor mange det er.
- Eksempel:
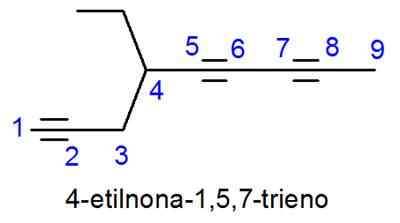
Nomenklatur av aromatiske forbindelser
Aromatiske hydrokarboner utnevnes som benzenderivater og både nummereringen og måten å navngi dem avhenger av hvor mange substituenter ringen har.
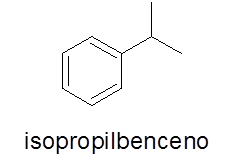
Aromatiske ringer med en enkelt substituent
I dette tilfellet er det ikke nødvendig. Navnet består av navnet på grenen etterfulgt av ordet benzen.
- Eksempel:
Aromatiske ringer med to substituenter
I dette tilfellet kan 3 tall eller erstatningsmønstre gis (1.2), (1.3) og (1,4). Som det er likegyldig å indikere hvilken erstatning som er i karbon 1 og hvilken i den andre, ortho prefikser (o-), henholdsvis meta- (m-) og para- (p-) for å referere til det samme.
- Eksempler:
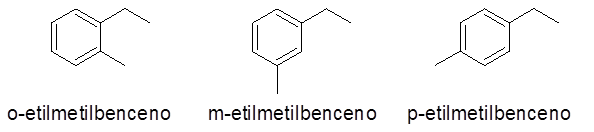
Aromatiske ringer med mer enn 2 substituenter
I dette tilfellet er nummereringen av den minste kombinasjonen av lokalisering valgt. Hvis to tall er like, blir det prioritert til substituenter i henhold til den alfabetiske rekkefølgen.
- Eksempler:
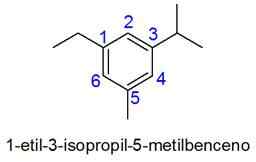
Eksempler på umettede hydrokarboner
Deretter blir flere eksempler på umettede hydrokarboner presentert for de som allerede er nevnt.
Acetylen (ca2H2)
Acetylen er det vanlige navnet på etino, den enkleste alkyminen. Denne forbindelsen har 2 umettethet på grunn av sin trippelkobling og brukes blant annet i stål- og sveiseutstyr.
Cyclohexen (ca6H10)
6 -karbon syklisk alken som har to umettethet: den ene på grunn av syklusen og den andre på grunn av dobbeltbindingen.
Strekk (c8H8)
Denne forbindelsen brukes ofte i polymerforberedelse. Det er en aromatisk alken med 5 umettethet.

