Katalytisk hydrogenering
- 1012
- 113
- Theodor Anders Hopland
 Katalytisk hydrogenering er en kjemisk reaksjon der det endelige resultatet er tilsetning av hydrogen til en annen forbindelse. Kilde: Gabriel Bolívar
Katalytisk hydrogenering er en kjemisk reaksjon der det endelige resultatet er tilsetning av hydrogen til en annen forbindelse. Kilde: Gabriel Bolívar Hva er katalytisk hydrogenering?
De Katalytisk hydrogenering Det er den kjemiske reaksjonen som molekylært hydrogen tilsettes i en forbindelse med høyere hastigheter.
H -molekulaen2 Ikke bare må først bryte sin kovalente binding, men også å være så liten, effektive kollisjoner mellom den og forbindelsen til der det vil bli lagt til er mindre sannsynlig.
Hydrogenreseptorforbindelsen kan godt være organisk eller uorganisk. I organiske forbindelser er de der det er de fleste eksempler på katalytisk hydrogenering, spesielt de som har farmakologisk aktivitet, eller har metaller innlemmet i strukturene sine (organometalliske forbindelser).
Når H blir lagt til2 For en struktur full av karbon, er det som skjer at dens umettet avtar, det vil si karbon når den maksimale grad av enkle koblinger som det kan dannes.
Derfor h2 Dobbelt (c = c) og trippel (C≡C) koblinger legges til, selv om det også kan legges til Carbonil -grupper (C = O).
Dermed reagerer alkener og alkiner ved katalytisk hydrogenering. Omfattende analyse av enhver struktur, kan det forutses om den vil legge til eller ikke h2 Bare oppdag doble og trippelkoblinger.
Kjennetegn på katalytisk hydrogenering
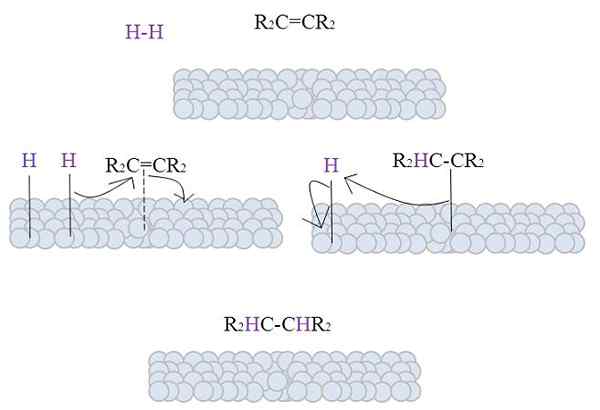
Bildet viser mekanismen for denne reaksjonen. Det er imidlertid nødvendig å adressere noen teoretiske aspekter før du beskriver det.
Overflatene til de grå kulene representerer metallatomene som, som det vil bli sett, er katalysatorene for hydrogenering av dyktighet.
Hydrogenbinding sprenger
- Hydrogenering er en eksoterm reaksjon, det vil si at den frigjør varme som et resultat av dannelsen av lavere energiforbindelser.
Kan tjene deg: Acetanylide (C8H9NO)- De dannede C-H-bindingene er stabile, som krever større energi for senere brudd enn H-H-bindingen av molekylære hydrogenbehov.
- Hydrogenering involverer alltid først brudd på H-H-koblingen. Dette bruddet kan være homolitisk, som i mange tilfeller:
H-h => h ∙ + ∙ h
Eller heterolytisk, som for eksempel kan gis når sinkoksid er hydrogen, ZnO:
H-h => h+ + H-
- Forskjellen mellom de to bruddene ligger i hvordan koblingselektroner distribueres. Hvis de distribueres likt (kovalent), ender hver H opp med å beholde et elektron, mens hvis fordelingen er ionisk, ender en uten elektroner, h+, Og den andre vinner dem helt, h-.
- Begge rupturer er mulig i katalytisk hydrogenering, selv om homolitisk tillater å vike for utviklingen av en logisk mekanisme for dette.
Eksperimentell
- Hydrogen er en gass, og derfor må det være sprudlende og garantere at bare han dominerer på overflaten av væsken.
- Hydrogenarforbindelse må solubiliseres i et medium, det være seg vann, alkohol, eter, estere eller en flytende amin. Ellers ville hydrogenering passere veldig sakte.
Oppløste forbindelsen til hydrogenar, må det også være en katalysator i reaksjonsmediet. Dette vil være ansvarlig for å akselerere hastigheten på reaksjonen.
- Ved katalytisk hydrogenering brukes vanligvis fint delte metaller av nikkel, paladium, platina eller rhodium, som er uoppløselige i nesten alle organiske løsningsmidler. Derfor vil det være to faser: en væske med oppløste forbindelser og hydrogen, og et fast stoff, den av katalysatoren.
Det kan tjene deg: Cruise for Crucible: Egenskaper, funksjoner, bruk eksempler- Disse metallene gir sin overflate slik at hydrogen og forbindelse reagerer, slik at bindingsbrudd blir fremskyndet.
- De reduserer også formidlingsområdet til arten, og øker antall effektive molekylære kollisjoner. Ikke bare det, men selv reaksjonen foregår i porene til metallet.
Typer katalytisk hydrogenering
Homogen
Det er snakk om homogen katalytisk hydrogenering når reaksjonsmediet består av en enkelt fase. Her bruk av metaller i deres rene tilstander, siden de er uoppløselige.
I stedet brukes organomethaliske forbindelser av disse metallene, som er oppløselige og har vist seg å ha høye utbytter.
En av disse organometalliske forbindelsene er Wilkinson -katalysatoren: Tris Chloride (Trifenylphin) Rodio, [(C6H5)3P]3Rhcl.
Disse forbindelsene danner et kompleks med H2, aktivere den for det påfølgende tilskuddet til alken eller alquino.
Homogen hydrogenering presenterer mange flere alternativer enn heterogen, fordi kjemi i organometalliske forbindelser er rikelig: det er nok til å endre metallet (PT, PD, RH, Ni) og ligandene (de organiske eller uorganiske molekylene knyttet til metallsenteret), til Få en ny katalysator.
Heterogen
Heterogen katalytisk hydrogenering, som nettopp nevnt, har to faser: en væske og ett fast stoff.
I tillegg til metallkatalysatorer, er det andre som består av en fast blanding. For eksempel Lindlar -katalysatoren, som er sammensatt av platina, kalsiumkarbonat, blyacetat og kinolin.
Lindlar -katalysatoren har den særegenheten at den er dårlig for hydrogenering av alkener. Imidlertid er det veldig nyttig for delvise hydrogenasjoner, det vil si at det fungerer utmerket på alkinene:
Kan tjene deg: lutecio: struktur, egenskaper, bruk, innhentingRC≡CR + H2 => Rhc = chr
Mekanisme
Bildet viser mekanismen for katalytisk hydrogenering ved bruk av et pulverisert metall som katalysator.
De grå kulene tilsvarer metalloverflaten til, for å si, platina. Molekylet h2 (lilla farge) er nær metalloverflaten, så vel som den erstatnings tetra alken, r2C = Cr2.
H2 Samhandling med elektronene som reiser metallatomene, og en pause og dannelse av en H-M-tidsmessig kobling oppstår, der M er metall. Denne prosessen er kjent som kjemisorpsjon. Det vil si en adsorpsjon av kjemiske krefter.
Alken samhandler på lignende måte, men lenken danner den med dobbeltbindingen (stiplet linje).
H-H-bindingen har allerede dissosiert, og hvert hydrogenatom forblir knyttet til metall. Tilsvarende gjør det med metallsentre i organometalliske katalysatorer, og danner et H-M-H mellomliggende kompleks.
Det forekommer deretter en migrasjon av en H mot dobbeltbindingen, og dette åpner for å danne en kobling med metallet. Deretter blir den gjenværende h seg sammen med det andre karbonet fra den opprinnelige dobbeltbindingen, og alkanen produseres blir endelig utgitt, r2HC-Chr2.
Denne mekanismen vil bli gjentatt så mange ganger som nødvendig, til alle H2 har reagert fullstendig.
Referanser
- Carey, f. (2008). Organisk kjemi. Mc Graw Hill.
- Shiver & Atkins (2008). Uorganisk kjemi. Mc Graw Hill.
- Lew, J. (s.F.). Katalytisk hydrogenering av alkener. Chem kom seg.Librettexts.org
- Hva er katalytisk hydrogenering? - Mekanisme og reaksjon. Studie ble frisk.com

