Litiumhydridstruktur, egenskaper, innhenting, bruk
- 4029
- 265
- Thomas Karlsen
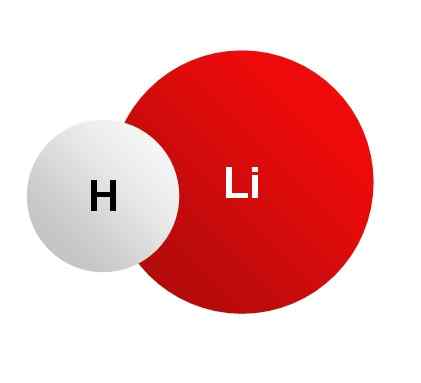
Han Litiumhydrid Det er et krystallinsk uorganisk fast stoff hvis kjemiske formel er lih. Det er det mest lette uorganiske saltet, molekylvekten er bare 8 g/mol. Det dannes ved foreningen av et litiumion li+ og et hydrid h ion-. Begge er forent av et ionisk bånd.
Lih har et høyt smeltepunkt. Det reagerer lett med vann og i reaksjonen oppstår hydrogengass. Det kan oppnås ved reaksjon mellom smeltet litiummetall og hydrogengass. Det er mye brukt i kjemiske reaksjoner for å oppnå andre hydror.
 Litiumhydrid, lih. Ingen maskinlesbar forfatter gitt. Jtiago antok (basert på copyright -krav). [Offentlig domene]. Kilde: Wikimedia Commons.
Litiumhydrid, lih. Ingen maskinlesbar forfatter gitt. Jtiago antok (basert på copyright -krav). [Offentlig domene]. Kilde: Wikimedia Commons. LIH har blitt brukt for beskyttelse mot farlig stråling som de som finnes i kjernefysiske reaktorer, disse er, alfa, beta, gammastråling, protoner, x -stråler og nøytroner.
Det er også blitt foreslått for beskyttelse av materialene i romrakettene som er flyttet av kjernefysisk termisk fremdrift. Studier blir til og med brukt til å brukes som en beskyttelse av mennesket mot kosmisk stråling under fremtidige turer til planeten Mars.
[TOC]
Struktur
I litiumhydrid har hydrogen en negativ belastning H-, Vel, et elektron har stjal til metallet, som er i form av ion Li+.
Elektronisk kationkonfigurasjon Li+ Det er: [han] 1s2 som er veldig stabil. Og den elektroniske strukturen til hydrid h- Det er: 1s2, som også er veldig stabil.
Kation og anion binder av elektrostatiske krefter.
Litiumhydridkrystallen har samme struktur som natriumklorid, det vil si en kubikk krystallinsk struktur.
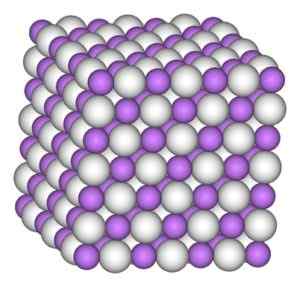 Kubikk krystallinsk struktur av litiumhydrid. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons.
Kubikk krystallinsk struktur av litiumhydrid. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons. Nomenklatur
- Litiumhydrid
- Lih
Egenskaper
Fysisk tilstand
Hvit eller fargeløs krystallinsk faststoff. Kommersiell lih kan være gråaktig blå på grunn av tilstedeværelsen av små mengder litiummetall.
Molekylær vekt
8 g/mol
Smeltepunkt
688 ºC
Kokepunkt
Den dekomponerer ved 850 ºC.
Selvordemperatur
200 ºC
Tetthet
0,78 g/cm3
Løselighet
Reagere med vann. Det er uoppløselig i etere og hydrokarboner.
Andre egenskaper
Litiumhydrid er mye mer stabilt enn hydrosen til de andre alkaliske metaller og kan smeltes uten nedbrytning.
Kan servere deg: tørt batteriDet påvirkes ikke av oksygen hvis det varmes opp ved temperaturer under rød. Det påvirkes heller ikke av klor CL2 og HCl saltsyre.
LIH -kontakt med varme og fuktighet forårsaker en eksoterm reaksjon (genererer varme) og hydrogenutvikling H2 og litiumhydroksyd lioh.
Det kan danne et fint støv som kan utnytte i kontakt med flammer, varme eller oksidere materialer. Du skal ikke kontakte lystgass eller flytende oksygen, da det kan utnytte eller slå på.
Det mørkner ved å bli utsatt for lys.
Å skaffe
Litiumhydrid er oppnådd i laboratoriet ved reaksjon mellom smeltet litiummetall og hydrogengass ved en temperatur på 973 K (700 ° C).
2 li + h2 → 2 lih
Gode resultater oppnås når den utsatte overflaten til det smeltede litiumet økes og når LiH -sedimentasjonstiden reduseres. Det er en eksotermisk reaksjon.
Jeg bruker som et beskyttende skjold mot farlig stråling
LIH presenterer en serie egenskaper som gjør det attraktivt å brukes som beskyttelse for mennesker i atomreaktorer og romsystemer. Her er noen av disse egenskapene:
- Det har et høyt hydrogeninnhold (12,68 % vekt på H) og et høyt antall hydrogenatomer per volum enhet (5,85 x 1022 H/cm -atomer3).
- Det høye smeltepunktet gjør at det kan brukes i miljøer med høy temperatur uten å bli grunnlagt.
- Den har et lavt dissosiasjonstrykk (~ 20 torr på smeltepunktet) som gjør at materialet kan støpes og frosset uten å nedbryte under lavt hydrogentrykk.
- Den har en lav tetthet som gjør det attraktivt å brukes i romsystemer.
- Imidlertid er deres ulemper deres lave varmeledningsevne og dårlige mekaniske egenskaper. Men dette har ikke redusert anvendeligheten.
- LIH -stykker som fungerer som skjold er produsert av kald eller varm pressing og ved fusjon og strømmer i former. Selv om denne siste formen er å foretrekke.
- Ved romtemperatur er delene beskyttet mot vann- og vanndamp.
- I atomreaktorer
I atomreaktorer er det to typer stråling:
Kan tjene deg: syrer og baser i hverdagen: reaksjoner, bruksområder, eksemplerDirekte ioniserende stråling
De er svært energipartikler som har elektrisk ladning, for eksempel alfa (α) og beta (β) og protonpartikler. Disse strålingstypene samhandler veldig sterkt med materialene i skjoldene, noe som forårsaker ionisering når de samhandler med elektronene til materialene til materialene de passerer.
Indirekte ioniserende stråling
De er nøytroner, gammastråler (γ) og x -løp, som er gjennomtrengende og krever massebeskyttelse, siden de involverer utslipp av lastede sekundære partikler, som er de som forårsaker ionisering.
 Symbol for å advare om farlig stråling. IAEA & ISO [Public Domain]. Kilde: Wikimedia Commons.
Symbol for å advare om farlig stråling. IAEA & ISO [Public Domain]. Kilde: Wikimedia Commons. I følge noen kilder er LIH effektivt i å beskytte materialer og mennesker mot denne typen stråling.
- I kjernefysiske termiske fremdriftsromsystemer
LIH er nylig valgt som en potensiell moderator og beskyttende materiale mot kjernefysisk stråling for kjernefysiske termiske fremdriftssystemer for romfartøy for veldig lang reise.
 Kunstnerisk representasjon av romkjøretøy med kjernefysisk fremdrift i banen til Mars. NASA/SAIC/PAT Rawlings [Public Domain]. Kilde: Wikimedia Commons.
Kunstnerisk representasjon av romkjøretøy med kjernefysisk fremdrift i banen til Mars. NASA/SAIC/PAT Rawlings [Public Domain]. Kilde: Wikimedia Commons. Dets lave tetthet og høyt hydrogeninnhold fører til at massen og volumet av kjernefysisk fremdriftsreaktor effektivt reduserer.
- I beskyttelse mot kosmisk stråling
Eksponering for romstråling er den viktigste risikoen for menneskers helse i fremtidige interplanetære letemisjoner.
I det dype rommet vil astronauter bli utsatt for det komplette spekteret av galaktiske kosmiske stråler (høye energiioner) og utkastingshendelser i solpartikkel (protoner).
Faren for strålingseksponering forverres på grunn av oppdragets varighet. I tillegg må beskyttelsen av stedene som oppdagelsesreisende også vurderes.
 Future Habitat Simulation on Planet Mars. NASA [Public Domain]. Kilde: Wikimedia Commons.
Future Habitat Simulation on Planet Mars. NASA [Public Domain]. Kilde: Wikimedia Commons. I denne ideenes rekkefølge indikerte en studie utført i 2018 at Lih blant de beviste materialene gir den høyeste strålingsreduksjonen per gram per cm2, Dermed å være en av de beste kandidatene som skal brukes i beskyttelse mot kosmisk stråling. Imidlertid må disse studiene bli utdypet.
Jeg bruker som et middel til lagring og sikker hydrogentransport
Skaffe energi fra h2 Det er noe som har blitt studert i flere titalls år og allerede har funnet søknad om å erstatte fossilt brensel i transportkjøretøyer.
Kan tjene deg: Kjemisk balanse: Forklaring, faktorer, typer, eksemplerH2 Det kan brukes i brenselceller og bidra til reduksjon av samproduksjon2 og ikkex, dermed unngå drivhusffekten og forurensningen. Et effektivt system for lagring og transport av H er imidlertid ennå ikke funnet2 Sikkert, med lett, kompakt eller liten vekt, som kjører den raskt og slipper h2 like raskt.
Lih litiumhydrid er fra alkaliske hydror som har den høyeste lagringskapasiteten til H2 (12,7 vekt % H). Slipp h2 ved hydrolyse i henhold til følgende reaksjon:
Lih + H2O → Lioh + H2
LIH leverer 0,254 kg hydrogen for hver kg LiH. I tillegg har den en høy lagringskapasitet per volum enhet, noe som betyr at det er lett og er et kompakt medium for H -lagring2.
 Motorsykkel hvis drivstoff er hydrogen lagret i form av et metallisk hydrid som LIH. ELLER.S. DOE Energy Effection and Renewable Energy (USA) [Public Domain]. Kilde: Wikimedia Commons.
Motorsykkel hvis drivstoff er hydrogen lagret i form av et metallisk hydrid som LIH. ELLER.S. DOE Energy Effection and Renewable Energy (USA) [Public Domain]. Kilde: Wikimedia Commons. I tillegg dannes LiH lettere enn andre alkaliske metallhydror og er kjemisk stabil ved miljøtemperaturer og trykk. LIH kan transporteres fra produsenten eller leverandøren til brukeren. Deretter genereres hydrolyse av LiH H H -H2 Og dette brukes trygt.
Lioh litiumhydroksyd dannet kan returneres til leverandøren som regenererer litium ved elektrolyse, og deretter produseres igjen LIH.
LIH har også blitt studert med suksess for å bli brukt sammen med det dristige hydraccinet for samme formål.
Bruk i kjemiske reaksjoner
LIH tillater komplekse hydrorsyntese.
Det tjener for eksempel til å fremstille litiumtrietylborohydrid er som er en kraftig nukleofil i organiske haluros forskyvningsreaksjoner.
Referanser
- Sato, og. Og takeda, eller. (2013). Hydrogenlagring og transportsystem gjennom litiumhydrid ved bruk av smeltet saltteknologi. I smeltet salter kjemi. Kapittel 22, side 451-470. Gjenopprettet fra Scientedirect.com.
- ELLER.S. National Library of Medicine. (2019). Litiumhydrid. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov.
- Wang, l. et al. (2019). Undersøkelse av virkningen av temal-kjerneffekt av lichiumhydrid på reaktivt kjernefysisk kjernefysisk. Annals of Nuclear Energy 128 (2019) 24-32. Gjenopprettet fra Scientedirect.com.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Giraudo, m. et al. (2018). Akseleratorbaserte tester av skjermingseffektivitet av forskjellige materialer og flerårige ved bruk av lys og tunge ioner med høyt energi og tunge ioner. Strålingsforskning 190; 526-537 (2018). NCBI kom seg.NLM.NIH.Gov.
- Welch, f.H. (1974). Litiumhydrid: et romalderskjermingsmateriale. Nuclear Engineering and Design 26, 3, Februry 1974, side 444-460. Gjenopprettet fra Scientedirect.com.
- Simnad, m.T.(2001). Atomreaktorer: Skjerming av materialer. I Encyclopedia of Materials: Science and Technology (Second Edition). Side 6377-6384. Gjenopprettet fra Scientedirect.com.
- Hügy, t. et al. (2009). Hydrazinboran: Et lovende hydrogenlagringsmateriale. J. ER. Chem. Soc. 2009, 131, 7444-7446. Gjenopprettet fra puber.ACS.org.
- « Amenadiel Betydning, tilstedeværelse i Bibelen og Lucifer
- Mayan medisinhistorie, Gud, planter, sykdommer »

