Magnesiumhydridstruktur, egenskaper og bruk
- 2048
- 531
- Dr. Andreas Hopland
Han Magnesiumhydrid (Mgh2 av molekylær formel), er det en kjemisk forbindelse med hydrogenvektinnhold av en 7.66%, og funnet i naturen som et hvitt krystallinsk faststoff. Det brukes hovedsakelig til å fremstille andre kjemiske stoffer, selv om det også har blitt studert som et gjennomsnittlig lagringspotensial for hydrogen.
Det tilhører familien av saltvann (eller ioniske) hydror, de som er definert av et negativt lastet ion. Disse hydridene regnes som de som er dannet av alkaliske metaller og skremmende alkaliske metaller, men når det.
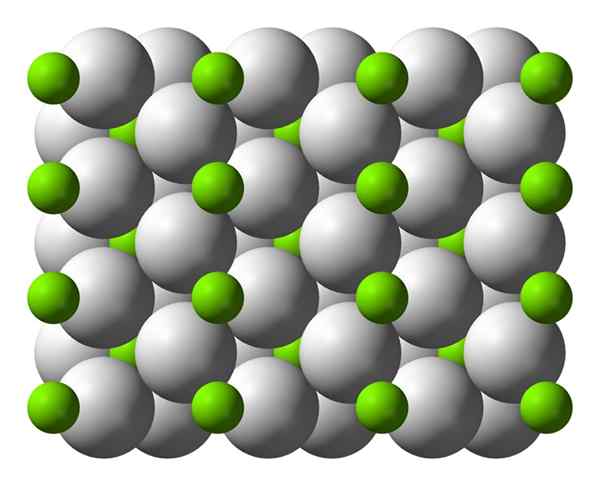
 Unitary Magnesium Hydride Cell Model, MGH2.
Unitary Magnesium Hydride Cell Model, MGH2. [TOC]
Forberedelse og formel
Magnesiumhydrid dannes gjennom direkte hydrogenering av metallisk magnesium (Mg) under høye trykk og temperaturforhold (200 atmosfærer, 500 ° C) med en MGI -katalysator2. Reaksjonen din tilsvarer:
Mg+h2→ MGH2
MGH -produksjon er også undersøkt2 Ved lavere temperaturer med bruk av nanokrystallinsk magnesium produsert i kulefabrikker.
Det er også andre preparatmetoder, men de representerer mer komplekse kjemiske reaksjoner (hydrogenering av magnesium-antracen; reaksjonen mellom dietylmagnesium med litium-aluminiumhydrid; og som et produkt av et MGH-kompleks2).
Kjemisk struktur
 Krystallinsk struktur av magnesiumhydrid
Krystallinsk struktur av magnesiumhydrid Dette atomet har en rutilo -struktur ved romtemperatur, med en tetragonal krystallinsk struktur. Den har minst fire forskjellige former under høye trykkforhold, og en ikke-ståstruktur er blitt observert med hydrogenmangel; Sistnevnte presenteres bare i veldig små mengder partikler når de dannes.
Som nevnt ovenfor, har koblingene som finnes i rutilo -strukturen delvis kovalente egenskaper i stedet for å være rent ioniske, for eksempel andre salthydros.
Dette fører til at magnesiumatomet har en sfærisk, totalt ionisert form, men at dets hydridion er en langstrakt struktur.
Magnesiumhydridegenskaper
Fysiske egenskaper
- Utseende: hvite krystaller.
- Molmasse: 26.3209 g/mol
- Tetthet: 1.45 g/cm3
- Fusjonspunkt: 285 ° C brytes ned
- Løselighet: I vann brytes det sammen.
Denne kjemiske forbindelsen har en molekylvekt på 26.321 g/mol, en tetthet på 1.45 g/cm³ og har et fusjonspunkt på 327 ºC.
Kjemiske egenskaper
- Forløper for fremstilling av andre kjemikalier.
- Hydrogenlagring, som en mulig energikilde.
- Reduksjonsmiddel i organisk syntese.
Det er viktig å indikere at denne forbindelsen ikke kan bringes til flytende tilstand, og når den tas eller smeltepunktet eller introduseres i vann, dekomponerer den. Dette hydridet er uoppløselig i eter.
Det er et svært reaktivt og ekstremt brennbart stoff, og det er også pyroforisk, det vil si at det kan betas spontant i luften. Disse tre forholdene representerer sikkerhetsrisikoer som vil bli nevnt i den siste delen av denne artikkelen.
Bruk/applikasjoner
Hydrogenlagring
Magnesiumhydrid reagerer lett med vann for å danne hydrogengass, gjennom følgende kjemiske reaksjon:
Mgh2+2H2O → 2H2+MG (OH)2
I tillegg dekomponerer dette stoffet ved temperaturen på 287 ºC og 1 bartrykk, som følger:
Mgh2→ Mg+H2
Derfor er bruk av magnesiumhydrid som hydrogenlagringsmiddel for bruk og transport blitt foreslått.
Hydrogenering og dehydrogenering av en mengde metallisk magnesium heves som en måte å transportere.
Hydrogenering og dehydrogeneringsreaksjoner
Selv om dekomponeringstemperaturen til magnesiumhydridet representerer en begrensning for bruk, er det hevet metoder for å forbedre kinetikken til hydrogenering og dehydrogeneringsreaksjoner. En av disse er med reduksjon av størrelsen på magnesiumpartikkelen med bruk av kulefabrikker.
Kan tjene deg: inhomogent systemSøle
I tillegg er det hevet et system som produserer et gjørmeformet magnesiumhydrid (mer håndterbart og sikkert at i støv eller andre faste partikler), som vil bli reagert med vann for å oppnå ønsket hydrogen.
Det anslås at den tidligere utnevnte gjørmen ville bli dannet av et fint malt hydrid, beskyttet med et oljekreftlag og suspendert i dispergeringsmidler for å sikre at den opprettholder sin konsistens uten materiell tap, og at den ikke absorberer fuktigheten i miljøet.
Denne gjørmen har fordelen at den kan pumpes gjennom enhver vanlig diesel, bensin eller vannpumpe, noe som gjør dette økonomiske forslaget i tillegg til effektiv.
Brenselsceller
Magnesiumhydrid kan implementeres i produksjonen av avanserte brenselceller, og også ved å lage batterier og energilagring.
Transport og energi
I løpet av de siste tiårene har hydrogenbruk blitt betraktet som en energikilde. Implementering av hydrogen som drivstoff, krever å finne trygge og reversible lagringssystemer og med høy volumetrisk kapasitet (mengde hydrogen per volum enhet) og gravimetrisk (mengde hydrogen per masseenhet).
Alkylering
Alco3R) av organiske forbindelser i basisk medium, der det er tilstedeværelse av grupper -OH i lave konsentrasjoner og temperaturer høyere enn smeltepunktet for hydrid.
I dette tilfellet hydrogener som er til stede i magnesiumhydrid (MGH2), Blir de sammen med gruppene -OH -dannende vann. Gratis magnesium kan motta halogenet som ofte følger med det alquiliske molekylet som er ment å forene hydrokarbonkjeden.
Risiko
Vannreaksjon
Som allerede nevnt er magnesiumhydrid et stoff som reagerer veldig enkelt og voldsomt med vann, og presenterer evnen til å utnytte i store konsentrasjoner.
Kan tjene deg: Grunnleggende salter: Formel, egenskaper, nomenklatur, eksemplerDette skjer fordi dens eksotermiske reaksjon genererer tilstrekkelig varme til å antenne hydrogengass som frigjøres i nedbrytningsreaksjonen, noe som fører til en ganske farlig kjedereaksjon.
Det er pyroforisk
Magnesiumhydrid er også pyroforisk, noe som betyr at det kan slå på flammer spontant i nærvær av fuktig luft, og danne oksyd av magnesium og vann.
Dets inhalasjon i fast tilstand eller kontakt med damper anbefales ikke: stoffet i naturlig tilstand og dets nedbrytningsprodukter kan forårsake alvorlige skader eller til og med død.
Det kan generere etsende løsninger i kontakt med vann og forurensning av det. Hud og øyne kontakt anbefales ikke, og genererer også irritasjon i slimhinnene.
Det er ikke vist at magnesiumhydrid kan generere kroniske helseeffekter, for eksempel kreft, reproduktive defekter eller andre fysiske eller mentale konsekvenser, men bruk av beskyttelsesutstyr når manipulerer det anbefales (spesielt åndedrettsvern eller masker, med dets fine pulverarakter).
Når du arbeider med dette stoffet, må fuktigheten av luften på lave nivåer opprettholdes, slå av alle tennekilder og transportere den i trommer eller andre containerebeholdere.
Du bør alltid unngå å jobbe med store konsentrasjoner av dette stoffet når det kan unngås, siden muligheten for en eksplosjon reduseres betydelig.
Hvis et magnesiumhydridsøl blir presentert, må arbeidsområdet isoleres og støvet med et vakuumverktøy må isoleres. Du bør aldri bruke den tørre feiende metoden; øker mulighetene for en viss reaksjon med hydrid.
Referanser
- Zumdahl, s. S. (1998). Britannica Encyclopedia. Hentet fra Britannica.com.
- Pubchem. (2005). Pubchem Open Chemistry Database. Hentet fra Pubchem.NCBI.NLM.NIH.Gov.
- Trygt hydrogen, l. (2006). Green Car Congress. Hentet fra greencarconress.com.
- Chemicals, c. (n.d.). Cameo Chemicals. Hentet fra komokjemikalier.NOAA.Gov.
- Tjenester, n. J. (1987). New Jersey Department of Health and Senior Services. Hentet fra NJ.Gov.

