Kalsiumhydroksyd (Ca (OH) 2) Struktur, egenskaper, innhenting, bruk

- 3573
- 971
- Jonathan Carlsen
Han kalsiumhydroksid Det er en uorganisk forbindelse hvis kjemiske formel er Ca (OH)2. Det er et hvitt pulver som har blitt brukt i tusenvis av år, gjennom som det har vunnet flere tradisjonelle navn eller kallenavn; Blant dem kan vi nevne den kjedelige, døde, kjemiske, hydrede eller fine.
I naturen er det tilgjengelig i et lite rikelig mineral kalt Portlandita, i samme farge. På grunn av dette CA (OH)2 Det oppnås ikke direkte fra dette mineralet, men fra en varmebehandling, etterfulgt av hydrering, av kalkstein. Dette oppnås av Lime, Cao, som deretter slår av eller fukter for å produsere CA (OH)2.
 En fast prøve av kalsiumhydroksyd. Kilde: ChemicalInterest [Public Domain]
En fast prøve av kalsiumhydroksyd. Kilde: ChemicalInterest [Public Domain] CA (OH)2 Det er en relativt svak base i vann, siden den knapt kan oppløses i varmt vann; Men løseligheten øker i kaldt vann, fordi fuktigheten er eksotermisk. Imidlertid fortsetter grunnleggende.
Det har blitt brukt som pH -regulator for forskjellige materialer eller mat, i tillegg til å være en god kilde til kalsium med hensyn til dens masse. Den har applikasjoner i papirindustrien, i desinfeksjon av kloakk, i depilerende produkter, i dagligvarer laget av maismel.
Imidlertid har den viktigste bruken vært som konstruksjonsmateriale, da kalk er hydrert når du blandes med de andre ingrediensene i gipsen eller mørtelen. I disse herdede blandingene, Ca (OH)2 Absorbere karbondioksid i luften for å konsolidere sandkrystaller sammen med kalsiumkarbonat dannet.
For tiden utføres det fortsatt forskning med sikte på å utvikle bedre byggematerialer som har CA (OH)2 direkte i sammensetningen som nanopartikler.
[TOC]
Struktur
Krystall og dens ioner
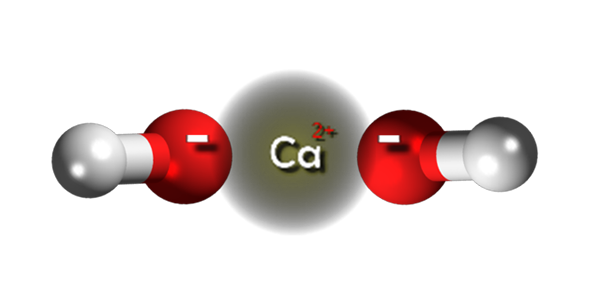 Kalsiumhydroksydioner. Kilde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Kalsiumhydroksydioner. Kilde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] I det øvre bildet har vi ionene som integrerer kalsiumhydroksid. Den samme CA -formelen (OH)2 påpeker det for hver kation Ca2+ Det er to OH -anioner- som samhandler med ham ved elektrostatisk attraksjon. Resultatet er at begge ionene ender opp med å etablere en sekskantet struktur krystall.
I slike sekskantede krystaller av Ca (OH)2 Ionene er veldig nær hverandre, noe som gir utseendet til å være en polymerstruktur; Selv om det ikke er noen formelt en kovalent binding CA-O, fremdeles gitt den bemerkelsesverdige forskjellen i elektronegativitet mellom de to elementene.
 Kalsiumhydroksydstruktur
Kalsiumhydroksydstruktur Strukturen genererer octaedros cao6, det vil si CA2+ samhandle med seks oh- (AC2+-Åh-).
Det kan tjene deg: litiumhydroksid (LIOH)En serie av disse oktaedraene utgjør et lag av glasset, som kan samhandle med et annet ved hydrogenbroer som opprettholder dem intermolekylært sammenhengende; Imidlertid blekner denne interaksjonen ved en temperatur på 580 ºC, når Ca (OH) er dehydrert2 til Cao.
På siden av høye trykk er det ikke mye informasjon om det, selv om studier bekreftet at det ved 6 GPa har en trykket på 6 GPa lider av en overgang fra den sekskantede til den monokliniske fasen; Og med dette, deformasjonen av Octaedros Cao6 og lagene.
Morfologi
Ca (OH) krystaller2 De er sekskantet, men det er ikke et hinder for dem å ta i bruk noen morfologi. Noen av disse strukturene (tråder, flak eller bergarter) er mer porøse enn andre, robuste eller flate, noe som direkte påvirker deres endelige applikasjoner.
Dermed er det ikke det samme å bruke krystaller fra Portland -mineralet, enn å syntetisere dem slik at de består av nanopartikler der noen få strenge parametere følges; slik som hydreringsgraden, konsentrasjonen av CaO som ble brukt, og tiden tillatt å dyrke glass.
Egenskaper
Fysisk utseende
Solid hvitt, toalett og bitter smak solid.
Molmasse
74.093 g/mol
Smeltepunkt
580 ºC. Ved denne temperaturen bryter den ned frigjøring av vann, så det når aldri til å fordampe:
CA (OH)2 => Cao + H2ENTEN
Tetthet
2.211 g/cm3
Ph
En vannaktig vannaktig løsning av den har en pH på 12,4 til 25 ºC.
Vannløselighet
Løseligheten av CA (OH)2 I vann avtar med en økning i temperaturen. Ved 0 ºC er for eksempel løseligheten 1,89 g/l; Mens de er ved 20 ºC og 100 ºC, er disse henholdsvis 1,73 g/l og 0,66 g/l.
Dette indikerer et termodynamisk faktum: CA -hydrering (OH)2 Det er eksotermisk, så å adlyde prinsippet om Le Catelier ligningen ville være:
CA (OH)2 Ac2+ + 2OH- + Q
Hvor slippes varmen. Jo varmere vannet, balansen vil ha mer til venstre; det vil si at CA (OH) vil oppløse mindre2. Det er av den grunn at i kaldt vann løses opp mye mer enn i kokende vann.
På den annen side øker denne løseligheten hvis pH blir syre, på grunn av nøytralisering av OH -ioner- og til forskyvningen av forrige balanse til høyre. Under denne prosessen frigjøres enda mer varme enn i nøytralt vann. I tillegg til sure vandige oppløsninger, CA (OH)2 Det er også løselig i glyserol.
K$
5.5 · 10-6. Denne verdien regnes som liten og stemmer overens med den lave løseligheten til CA (OH)2 I vannet (den samme balansen over).
Kan tjene deg: metallerBrytningsindeks
1.574
Stabilitet
CA (OH)2 Det forblir stabilt så lenge det ikke blir utsatt for CO2 av luften, siden den absorberer det og danner kalsiumkarbonat, Caco3. Derfor begynner det å bli impurifisert i en solid blanding av Ca (OH) -krystaller2-Tyv3, Der det er medanioner32- Konkurrer med OH- Å samhandle med CA2+:
CA (OH)2 + Co2 => Caco3 + H2ENTEN
Dette er faktisk grunnen til at de konsentrerte løsningene til CA (OH)2 De snur senger, ettersom en suspensjon av Caco -partikler vises3.
Å skaffe
CA (OH)2 Det oppnås kommersielt ved å reagere kalk, CAO, med et overskudd på to til tre ganger vann:
Cao + H2O => ca (å)2
Imidlertid kan karboniseringen av Ca (OH) oppstå i prosessen2, Akkurat som forklart ovenfor.
Andre metoder for å oppnå det består i bruk av løselige kalsiumsalter, for eksempel klikk2 eller CA (nei3)2, og baser dem med NaOH, slik at CA (OH) suser2. Kontrollere parametrene som volum av vann, temperatur, pH, løsningsmiddel, grad av karbonisering, modningstid, etc., Nanopartikler med forskjellige morfologier kan syntetiseres.
Det kan også tilberedes ved å velge naturlig og fornybar råstoff, eller avfallet av en industri, som er rike på kalsium, som når asken deres blir oppvarmet og behandlet vil bestå av kalk; Og herfra, igjen, kan CA (OH) utarbeides2 Ved å fuktige disse asken uten behov for å kaste bort kalkstein, Caco3.
For eksempel har Bagazo del Agave blitt brukt til dette formålet, og tilordnet en merverdi til avfallet av Tequila Industries.
applikasjoner
Matbehandling
 Pickles blir først gjennomvåt i kalsiumhydroksid for å være mer sprø. Kilde: Pixabay.
Pickles blir først gjennomvåt i kalsiumhydroksid for å være mer sprø. Kilde: Pixabay. Kalsiumhydroksid er til stede i mange matvarer i noen av dens forberedelsesstadier. For eksempel, i en vandig løsning av den, er pickles nedsenket, for eksempel agurker, for å gjøre dem mer knasende når du pakker dem i eddik. Dette er fordi proteinene fra overflaten deres absorberer kalsium i midten.
Tilsvarende oppstår det med maiskorn før du transformerer dem til mel, fordi det hjelper til å frigjøre vitamin B3 (Niacina) og letter det. Kalsium den gir brukes også til å tilføre ernæringsmessig verdi til visse juice.
CA (OH)2 Du kan også bytte ut bakepulver i noen brødoppskrifter, og avklare sukkeroppløsningene fra sukkerrør og rødbeter.
Kloakk desinfeksjonsmiddel
Avklarende handling av CA (OH)2 Det er fordi det fungerer som et flokkulant middel; det vil si at størrelsen på de suspenderte partiklene øker for å danne flocculus, som deretter sediment eller kan filtrere.
Kan tjene deg: Pauling ScaleDenne egenskapen har blitt brukt til å desinfisere kloakken, destabilisere dets ubehagelige kolloider i sikte (og lukt) av tilskuerne.
Papirindustri
CA (OH)2 Det brukes i Kraft -prosessen for å regenerere NaOH som brukes til å behandle tre.
Gassabsorberende
CA (OH)2 Det brukes til å eliminere CO2 av lukkede rom eller i miljøer der deres tilstedeværelse er kontraproduktiv.
Personlig pleie
I formuleringer for depilatoriske kremer CA (OH)2 Det er stilltiende, fordi dens basalitet hjelper til med svekkelsen av hårets keratin, og dermed er det lettere å fjerne dem.
Konstruksjon
 Kalsiumhydroksyd er en del av strukturene i gamle konstruksjonsarbeid som pyramidene i Egypt. Kilde: Pexels.
Kalsiumhydroksyd er en del av strukturene i gamle konstruksjonsarbeid som pyramidene i Egypt. Kilde: Pexels. CA (OH)2 Han har vært til stede siden uminnelige tider integrert massene av gips og mørtel brukt i konstruksjonen av egyptiske arkitektoniske arbeider som pyramider; Også bygninger, mausoleums, vegger, trapper, gulv, støtter og til og med for å gjenoppbygge tannsementet.
Den forsterkende handlingen skyldes at ved å "puste" CO2, Krystallene som følge av Caco3 Sandene og andre komponenter i slike blandinger ender opp i bedre grad.
Risiko og bivirkninger
CA (OH)2 Det er ikke et sterkt grunnleggende fast stoff sammenlignet med andre hydroksider, selv om mer enn MG (OH)2. Likevel, til tross for at de ikke er reaktiv eller brannfarlig, er dens basalitet fremdeles aggressiv nok til å forårsake svake forbrenninger.
Derfor må det manipuleres med respekt, fordi det er i stand til å irritere øynene, tungen og lungene, i tillegg til å utløse andre sykdommer som: tap av syn, alvorlig alkalinisering av blod, hudutslett, oppkast og smerter i halsen.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Hydroksydkalsium. Hentet fra: i.Wikipedia.org
- Chávez Guerrero et al. (2016). Syntese og karakterisering av kalsiumhydroksyd oppnådd fra agave bagasse og forskning av dens antibakterielle aktivitet. Gjenopprettet fra: Scielo.org.MX
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Krystallstruktur i høytrykksfasen av kalsiumhydroksyd, portlanditt: på situpulver og enkeltkrystall røntgen difffraksjonsstudie. Amerikansk mineralog; 98 (8-9): 1421-1428. Doi: doi.org/10.2138/am.2013.4386
- Hans Lohninger. (5. juni 2019). Hydroksydkalsium. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Aniruddha s. et al. (2015). Syntese av nano kalsiumhydroksyd i lidelsesmedium. American Ceramic Society. gjør jeg.org/10.1111/Jace.14023
- Carly Vandergrindt. (12. april 2018). Hvordan brukes kalsiumhydroksyd i mat, og er det trygt? Gjenopprettet fra: Healthline.com
- Brian Clegg. (26. mai 2015). Hydroksydkalsium. Gjenopprettet fra: Chemistryworld.com
- « Kjemiske fenomenekarakteristikker og eksempler
- Mesohyppus -egenskaper, arter, reproduksjon, ernæring »

