Kromhydroksydstruktur, egenskaper, syntese, bruk
- 1055
- 66
- Anders Mathisen
Han Kromhydroksyd Det er et uorganisk sammensatt produkt av reaksjonen av en base med kromsalt. Den kjemiske formelen varierer i henhold til kromoksidasjonsstatus (+2 eller +3, for denne typen forbindelse). Dermed har CR (OH)2 For kromhydroksyd (II), og CR (OH)3 For kromhydroksyd (III).
Av elektroniske årsaker, CR2+ er mer ustabil enn CR3+, Så Cr (OH)2 Det er et reduserende middel (mister et elektron for å flytte til +3). Selv om begge hydroksider kan oppnås som utfellinger, er CR (OH)3 -Også kalt kromhydroksyd- er den dominerende forbindelsen.
 Kromhydroksydutseende
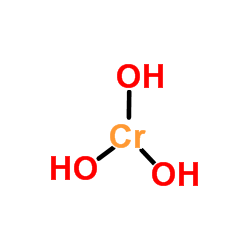
Kromhydroksydutseende I motsetning til de hydroksider oppnådd ved enkel oppløsning av metalloksider i vann, CR (OH)3 Det er ikke syntetisert med denne ruten på grunn av den dårlige løseligheten av kromoksid (CR2ENTEN3, Øvre bilde). Imidlertid CR (OH)3 Det regnes som CR2ENTEN3· XH2Eller, brukt som smaragdgrønt pigment (Guinet Green).
I laboratoriet er det basert på det metalliske krom, som er oppløst i syreoppløsning for dannelse av komplekset [CR (OH2)6]3+. Dette vandige komplekset reagerer deretter med en base (NaOH eller KOH) for å danne den tilsvarende kromhydroksid.
Hvis de foregående trinnene utføres under forhold som sikrer fravær av oksygen, stammer reaksjonen CR (OH)2 (Krom hydroksyd). Deretter er det nødvendig. Som et resultat er den sanne CR (OH) "født"3, Et grønt pulver med en polymer og usikker struktur.
[TOC]
Kromhydroksydstruktur
Det øvre bildet er den enkleste representasjonen av CR (OH)3 i gass og isolert fase. Også og antar den rent ioniske karakteren av dens interaksjoner, kan i de faste kationer visualiseres3+ samhandle med en triplikatmengde OH -anioner-.
Kan tjene deg: molar absorberendeImidlertid er arten av CR-OH-koblingen mer kovalent på grunn av CR-koordinasjonskjemi3+.
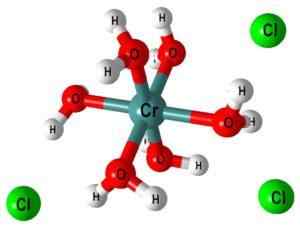
For eksempel komplekset [CR (OH2)6]3+ Det indikerer at det metalliske kromsenteret er koordinert med seks vannmolekyler; Ettersom disse er nøytrale, viser komplekset den positive belastningen på den opprinnelige kationen, CR3+.
Oktaedron og polymerisasjon
I det øvre bildet er strukturen til komplekset [CR (OH er representert2)6]3+. CL -ioner- De kan for eksempel komme fra saltsyre i tilfelle den har blitt brukt til oppløsning av salt eller kromoksid.
Når NaOH (eller KOH) tilsettes reaksjonsmediet, OH -ionen- Uns et molekyl av dette komplekset, som danner [CR (OH2)5(Åh)]2+ (Nå er det fem vannmolekyler fordi den sjette tapte et proton).
Fortløpende, dette nye dehydratkomplekset til et annet vandig kompleks, og skaper Dímeros forent av hydroksydbroer:
(H2ENTEN)5CR-OH-CR (Å2)5
Når mediets basalitet øker (pH stiger opp) komplekset [CR (OH2)4(ÅH)2]+, og øker også sannsynlighetene for nye hydroksydbroer for å skape gelé -polymerer. Faktisk nekter denne "grå -grønn gelé" å utfelle ordnet.
Til slutt, CR (åh2)3(ÅH)3 Den består av en oktaedron med CR3+ I sentrum, og knyttet til tre vannmolekyler og tre OH- som nøytraliserer deres positive ladning; Dette uten å vurdere polymerisasjon.
Når CR (åh2)3(ÅH)3 Det er dehydrert, det koordinerte vannet med CR elimineres3+, Og ettersom denne kationen er koordinert med seks arter (ligander), oppstår polymerstrukturer der CR-CR-koblinger er involvert.
Kan tjene deg: Butyric Fat: Innhenting, typer, sammensetning, bruksområder, fordelerNår dehydrert, kan strukturen vurderes av en CR -type2ENTEN3· 3H2ENTEN; Med andre ord, det av tri-hydratisert kromoksid. Imidlertid er det de fysisk -kjemiske studiene av det faste stoffet som kan kaste lys over den sanne strukturen til CR (OH)3 i dette punktet.
Fysiske og kjemiske egenskaper ved kromhydroksid
Cr (OH)3 Det ser ut som et blågrønnpulver, men når det kommer i kontakt med vann for det, danner en gråaktig grønn gelé.
Det er uoppløselig i vannet, men løselig i syrer og sterke baser. I tillegg, når den varmes opp, brytes den sammen, og produserer kromoksiddamp.
Anfoterisme
Hvorfor er kromhydroksydoppløselig i syre- og grunnleggende løsninger? Årsaken skyldes amfoterkarakteren, som lar deg reagere med både syrer og baser. Denne egenskapen er karakteristisk for CR3+.
Når du reagerer med syrer, CR (OH2)3(ÅH)3 Det er oppløst fordi hydroksylbroene er ødelagte, ansvarlige for gelékvinnen av bunnfallet.
På den annen side, når mer base blir lagt til, oh- De fortsetter å erstatte vannmolekylene, og danner det negative komplekset [CR (OH2)2(ÅH)4]-. Dette komplekset vender løsningen av en lysegrønn farge, som intensiveres når reaksjonen fortsetter.
Når alle CR (åh2)3(ÅH)3 Du har reagert, ett siste kompleks oppnås som indikert av den kjemiske ligningen:
Cr (åh2)3(ÅH)3 + 3 Å- [Cr (OH)6] 3- + 3 H2ENTEN
Dette negative komplekset er assosiert med omkringliggende kationer (NA+, Hvis basen er NaOH), og etter fordampning av vann, er natriumkromitosaltet (NACRO2, smaragdgrønn farge). Dermed er både syren og det baserte mediet i stand til å oppløse kromhydroksid.
Kan tjene deg: indiskSyntese av kromhydroksyd i industrifeltet
I industrien produseres det av kromsulfatutfelling med natrium- eller hydroksydhydroksydløsninger. På samme måte produseres kromhydroksyd ved skjematisert reaksjon:
Cro72- + 3 Så2 + 2H+ => 2 Cr3+ + 3 Så42- + H2ENTEN
Cr3+ + 3OH- => Cr (OH)3
Som vist i forrige prosedyre har kromreduksjon VI til krom III stor økologisk betydning.
Krom III er relativt ufarlig for biota, mens krom VI er giftig og kreftfremkallende, i tillegg til veldig løselig, så eliminering av miljøet er av betydning.
Vann- og jordbehandlingsteknologi inkluderer reduksjon fra CR (VI) til CR (III).
applikasjoner
Kromhydroksyd har forskjellige applikasjoner:
- Sminkeformulering.
- Hårfargestoffer.
- Neglelakk.
- Hudpleieprodukter.
- Rengjøringsprodukter.
- I metallfinishen, som representerer 73 % av forbruket i bransjen.
- I bevaring av tre.
Referanser
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). Cengage Learning, s 873, 874.
- Pubchem. Krom hydroksyd. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov
- Syntese, karakterisering og stabilitet av CR (III) og Fe (III) hydroksider. Papassiopi, n., Vaxevanidou, k., Christou, c., Karagianni, e. og Antipas, g. J. Hazard Mater. 264: 490-497.
- Prebchem. Forberedelse av krom (III) hydroksid. Gjenopprettet fra Prepchem.com
- Wikipedia. (2018). Krom (iii) hydroksid. Innhentet fra.Wikipedia.org