Nikkelhydroksyd (III) struktur, egenskaper, bruksområder, risikoer
- 4070
- 932
- Mathias Aas
Han Nikkelhydroksyd (III) Det er en uorganisk forbindelse der nikkelmetallet har et oksidasjonsnummer på 3+. Dens kjemiske formel er Ni (OH)3. I følge kildene som er konsultert, har det så langt ikke vært mulig å bekrefte eksistensen av nikkelhydroksyd (III) eller (OH)3, Men nikkelokso-hydroksid (III), barn (OH) er oppnådd.
Nikkel (iii) Nio (OH) Oxohydroxide er et svart krystallinsk fast stoff som krystalliserer på to måter: beta -formen og gamma. Den vanligste krystallinske formen (OH) er beta.
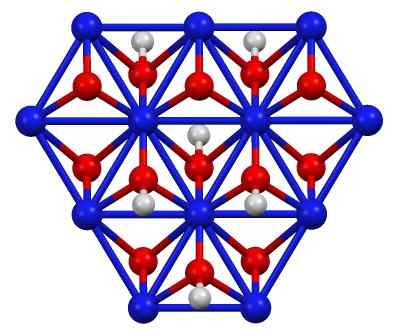
 Nikkeloksohydroksydstruktur (III), barn (OH). Blå = nikkel, rød = oksygen, hvitt = hydrogen. Forfatter: Smokefoot. Kilde: eget arbeid. Kilde: Wikipedia Commons
Nikkeloksohydroksydstruktur (III), barn (OH). Blå = nikkel, rød = oksygen, hvitt = hydrogen. Forfatter: Smokefoot. Kilde: eget arbeid. Kilde: Wikipedia Commons Barnet (OH) kan oppnås ved å oksidere nikkelnitratløsninger (II) (eller (nei3)2) med klor (CL2) eller brom (BR2) I nærvær av kaliumhydroksyd (KOH). Nikkel (iii) Oxohydroxide er veldig løselig i syrer. Den har påføring i nikkelbatterier, i Superca.
Nikkel (III) NIO (OH) og nikkelhydroksid (II) eller (OH) (OH)2 De er forent i driften av de fleste av applikasjonene sine, ettersom begge er en del av den samme oksidreduksjonsligningen.
Å være en nikkelforbindelse, presenterer barnet (OH) de samme risikoene for andre nikkelsalter, det vil si hudirritasjon eller dermatitt og kreft.
[TOC]
Krystallinsk struktur
Nikkeloksohydroksid (III) krystalliserer på to måter: beta og gamma. Beta β-Nio (OH) -formen har en struktur som er veldig lik ß-Ni (OH)2, Noe som virker logisk fordi den første kommer fra oksidasjonen av sistnevnte.
Gamma-formen fra y-Nio (OH) er oksidasjonsproduktet av nikkelhydroksyd (II) i sin alfa, α-Ni (OH) form2. I likhet med sistnevnte har gamma en lagstruktur med alkalisk metallioner, anioner og vann ispedd mellom lagene.
Elektronisk konfigurasjon
Hos barnet (OH) finnes nikkel i oksidasjonstilstanden 3+, noe som betyr at 3 elektroner mangler til de ytterste lagene, det vil si to elektroner i lag 4 manglers og et elektron fra lag 3d. Den elektroniske konfigurasjonen av Ni3+ I barnet (OH) er: [AR] 3d7, Hvor [ar] er den elektroniske konfigurasjonen av adelig argongass.
Det kan tjene deg: pi linkNomenklatur
- NIO (OH): Nikkel Oxohydroxide (III)
- Nikkel svart
Egenskaper
Fysisk tilstand
Svart krystallinsk faststoff.
Løselighet
Nio (OH) Oxohydroxide er veldig løselig i syrer. Gamma -fasen oppløses i svovelsyre med oksygenutvikling.
Andre egenskaper
I varmt vann blir det et oksohydroksid av nikkel (II) og (III), eller3ENTEN2(ÅH)4.
Den dekomponerer til 140 ºC i nikkel (ii) (barn og oksygenoksid.
Gamma-fasen (y-Nio (OH)) kan oppnås på flere måter, for eksempel å behandle nikkel med en smeltet blanding av natriumperoksyd (Na2ENTEN2) og natriumhydroksyd (NaOH) ved 600 ºC og avkjøling i isvann.
Gamma -fasen går i stykker når den varmes opp til 138 ºC.
applikasjoner
I nikkelbatterier
Edisons nikkel-hydrumbatteri, der KOH brukes som elektrolytt, er basert på nikkeloksohydroksydreaksjonen (III) med jern:
Nedlasting:
Fe + 2nio (OH) + H2Eller ⇔ tro (å)2 + 2ni (OH)2
Byrde:
Det er en reversibel oksidreduksjonsreaksjon.
I anoden til disse batteriene oppstår en serie kjemiske og elektrokjemiske prosesser. Nedenfor er en generell ordning:
nedlasting
β-ni (OH)2 ⇔ β-nio (OH) + H+ + og-
Byrde
Aldring ↑ ↓ overbelastning
nedlasting
α-ni (OH)2 ⇔ γ-nio (OH) + H+ + og-
Byrde
Kan tjene deg: arsen: historie, struktur, egenskaper, bruksområderI nikkelbatteriteknologi kalles nikkeloksohydroksyd (III) NIO (OH) "nikkel aktiv masse".
 Nikkeloppladbare batterier. Forfatter: SuperUsergeneric. Kilde: eget arbeid. Kilde: Wikipedia Commons.
Nikkeloppladbare batterier. Forfatter: SuperUsergeneric. Kilde: eget arbeid. Kilde: Wikipedia Commons. I elektrokatalyse som en regenerabel katalysator
Barnet (OH) har blitt brukt med suksess i elektrosyntesen av azopirazoler, gjennom elektrokatalittisk oksidasjon av aminopyrazoler. Dens nytte i syntesen av karboksylsyrer med start fra alkoholer eller karbonylforbindelser er også bevist.
 Å oppnå en karboksylsyre ved å oksidere en alkohol som er katalysert av barnet (OH). Kilde: Opprinnelig fra i.Wikipedia. Original forfatteropplaster var v8rik på i.Wikipedia. Kilde: Wikipedia Commons
Å oppnå en karboksylsyre ved å oksidere en alkohol som er katalysert av barnet (OH). Kilde: Opprinnelig fra i.Wikipedia. Original forfatteropplaster var v8rik på i.Wikipedia. Kilde: Wikipedia Commons Et annet eksempel er at den kvantitative konvertering av hydroksymetypyridin til en pyridokarboksylsyre. I dette tilfellet er stål- eller nikkelelektroden som tilsvarer anoden dekket med et lag med barn (OH). Mediet der elektrolyse utføres i er alkalisk.
I disse reaksjonene fungerer barnet (OH) som en reduksjon-outdoor-formidler, eller "redox" mediator.
Elektrolyse utføres i en celle med nikkelanode og titankatode, i alkalisk medium. Under prosessen er det dannet eller (OH)2 På overflaten av nikkelanoden, som raskt oksideres til barn (OH):
Ni (å)2 + Åh- - og- ⇔ Nio (OH) + H2ENTEN
Barnet (OH) reagerer med det organiske underlaget og det ønskede organiske produktet oppnås, og regenererer NI (OH)2:
Nio (OH) + organisk forbindelse → Ni (OH)2 + produkt
Når NI (OH) regenererer2, Katalysereaksjonen fortsetter.
Bruken av barnet (OH) som elektrokatisator gjør det mulig å oppnå organiske forbindelser med lave kostnader og på en miljøvennlig måte.
I Super Cardpisors
Barnet (OH) sammen med NI (OH)2 De utgjør utmerkede materialer for supercaiding elektroder (engelsk Supercapacitos).
Ni (å)2 + Åh- ⇔ Nio (OH) + H2Eller + e-
De har høy kapasitans, lave kostnader og ifølge noen referanser under miljøpåvirkning.
 Kondensatorer i en elektronisk krets. Forfatter: Pdphotos. Kilde: Pixabay.
Kondensatorer i en elektronisk krets. Forfatter: Pdphotos. Kilde: Pixabay. De har imidlertid lav konduktivitet. Dette løses ved bruk av nanopartikler av nevnte forbindelser, siden dermed øker overflatearealet og reduserer avstanden som kreves for diffusjon, noe som sikrer høy hastighet på overføring av elektroner og/eller ioner.
Kan tjene deg: elastiske materialerVed oksidasjon av metallioner
En av de kommersielle anvendelsene av nikkeloksohydroksid (III) er basert på dens evne til å oksidere koboltioner (II) i løsning på koboltioner (III).
Risiko
I løsning er nikkel mer stabil som et ion eller2+, Derfor er det ikke vanlig å komme i kontakt med NI3+. Forholdsreglene er imidlertid de samme, fordi nikkel, enten det.
Det anbefales å bruke verneutstyr og klær, for eksempel ansiktsskjold, hansker og sikkerhetssko. Alt dette må brukes hver gang det er mulighet for å komme i kontakt med nikkelløsninger.
Hvis dermatitt oppstår, bør den behandles med en lege for å utelukke at det er forårsaket av nikkel.
Når det gjelder muligheten for innånding, er det god praksis.
Alle nikkelforbindelser er klassifisert av International Cancer Research Agency, eller IARC (forkortelse for engelsk Internasjonalt byrå for kreftforskning), i kategorien kreftfremkallende.
Dette er basert på epidemiologiske og eksperimentelle data.
Referanser
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Lyalin, f.V. et al. Elektrosyntese av azopyrazoler via oksidasjon av n-alkylaminopyrazoler på et barn (OH) anode i vandig alkali-en grønn metode for N-N homokougle. Tetrahedronbrev. 59 (2018) 2741-2744. Gjenopprettet fra Scientedirect.com.
- Liuyang, Zhang, et al. (2018). Nikkelbaserte materialer for superkapacitos. Materialer i dag. Gjenopprettet fra Scientedirect.com
- Etel, v.TIL. og Mosolu, m. TIL. (1977). Forberedelse av nikkel svart. ELLER.S. Patent nr. 4.006.216. 1. februar 1977.
- Scharbert, f. (1993). Prosess for oksiderende hydroksymetylpyridinderivater til pyridinekarboksylsyrederivater ved nikkeloksydhydroksydanoder. ELLER.S. Patent nr. 5.259.933. 9. november 1993.
- Kirk-Ohmer (1994). Encyclopedia of Chemical Technology. Volum 17. Fjerde utgave. John Wiley & Sons.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte utgave. Volum på 17. VCH Verlagsgellschaft MBH.
- McBreen, James. (1997). Nikkelhydroksider. I håndbok for batterimaterialer. VCH Publisher. Gjenopprettet fra Osti.Gov.
- « Makrokompatører Historie, egenskaper, bruksområder, eksempler
- Utvalgte analoge datamaskiner, komponenter, typer »

