Isóbaros
- 1555
- 160
- Anders Mathisen
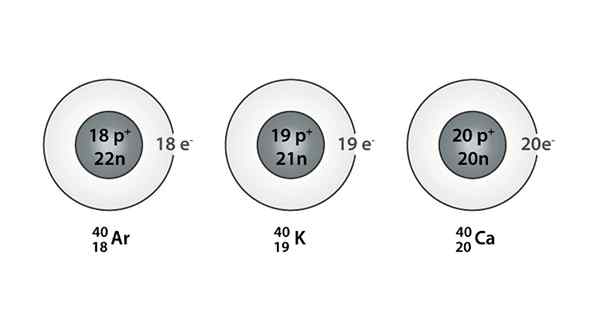
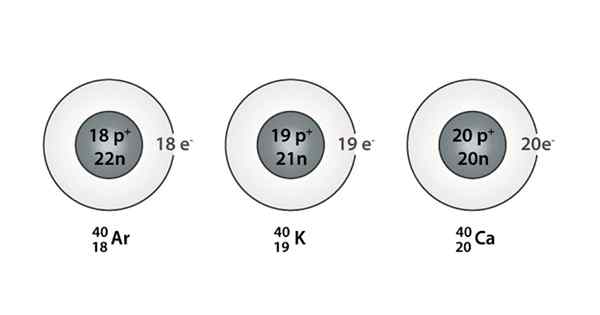 Eksempel på Isóbaro; Argon, kalium og kalsium, som har atomer med samme masse (40)
Eksempel på Isóbaro; Argon, kalium og kalsium, som har atomer med samme masse (40) Hva er Isoparos?
De Isóbaros De er de atomartene som har samme masse, men som kommer fra forskjellige kjemiske elementer. Som en konsekvens av dette kan det sies at de utgjøres av forskjellige antall protoner og nøytroner.
Både protoner og nøytroner er i kjernen til atomene sine, men netto mengde nøytroner og protoner som er til stede i hver kjerne forblir den samme. Med andre ord, en Isóbara -art har sin opprinnelse når et par atomkjerner viser det samme nettetallet nøytroner og protoner for hver art.
Antallet nøytroner og protoner som utgjør det netto beløpet er imidlertid annerledes. En måte å legge merke til det på er å observere massetallet (som er plassert på øvre venstre side av symbolet på det kjemiske elementet som er representert), for i isopiene er dette tallet det samme er det samme er det samme.
Etymologien til Isóbaro -uttrykket kommer fra greske ord Isos (som betyr "det samme") og Baros (som betyr "vekt"), som refererer til likestilling av vekter mellom begge kjernefysiske arter.
Kjennetegn på isoparos
- Isoparos holder visse likheter med andre arter hvis kjerner presenterer tilfeldigheter, for eksempel det isotone, som har samme mengde nøytroner, men med forskjellig masse og atomnummer, for eksempel jevnaldrende 1. 3C og 14Nei 36S og 37Cl.
- Begrepet "nukleid" er kirkesamfunnet som er blitt myntet til hvert av nukleasettene (strukturer dannet av nøytroner og protoner) som kan dannes. Slik at nukleidene muligens skiller seg ut med antall nøytroner eller protoner, eller til og med for mengden energi som strukturen i konglomerasjonen besitter.
Kan tjene deg: Liativ: konsept, gasser, jordsmonn og seismikk, sæd- På samme måte er det en barnekjerne oppstår etter β, og denne prosessen er på sin side en isopar av farkjernen, fordi antallet nukleoner som er til stede i kjernen forblir uendret, i motsetning til hva som skjer ved hjelp av oppløsning α.
- Det er viktig å huske at de forskjellige Isóbaros har forskjellige atomnummer, og bekrefter at de er forskjellige kjemiske elementer.
Representasjon
For å betegne de forskjellige nukleidene brukes en spesifikk notasjon, som kan representeres på to måter: en består i å plassere navnet på det kjemiske elementet etterfulgt av deres massenummer, som er forent av et skript. For eksempel: nitrogen-14, hvis kjerne består av syv nøytroner og syv protoner.
Den andre måten å representere disse artene på er å plassere symbolet på det kjemiske elementet, foran en numerisk superstice som indikerer massenummeret som det aktuelle atomet har, samt et numerisk abonnement som utpeker atomnummeret, på følgende måte :
ZTILX
I dette uttrykket x representerer det det kjemiske elementet i det aktuelle atomet, a er massetallet (resultat av tilsetningen mellom mengden nøytroner og protoner) og z representerer atomnummeret (lik mengden protoner i kjernen av atomet).
Når disse nukleidene er representert, blir atomnummeret til atomet (z) vanligvis utelatt fordi det ikke gir relevante tilleggsdata, så det er ofte representert som TILX.
En måte å vise denne notasjonen på er å ta det forrige eksemplet (nitrogen-14), som også er betegnet som 14N. Dette er notasjonen som brukes til Isoboos.
Kan tjene deg: omfattende egenskaper av materieEksempler på Isóbaros
Bruken av uttrykket "isóbaros" for arter kjent som nukleider som har samme antall nukleoner (like massetall) ble foreslått på slutten av 1910 -tallet av kjemikeren til British Origin Alfred Walter Stewart.
I denne orden av ideer kan et eksempel på isoboos observeres i tilfelle av arter 14C og 14N: Massetallet er lik 14, dette innebærer at antallet protoner og nøytroner i begge artene er annerledes.
Dette karbonatom har faktisk et atomnummer lik 6, så i sin struktur er det 6 protoner, og på sin side har det 8 nøytroner i kjernen. Da er massenummeret ditt 14 (6+8 = 14).
For sin del har nitrogenatomet et atomnummer lik 7, så det består av 7 protoner, men det har 7 nøytroner i kjernen. Massenummeret ditt er også 14 (7+7 = 14).
Du kan også finne en serie der alle atomer har et massetall lik 40; Dette er tilfelle av Isóbaros: 40Ac, 40K, 40Ar, 40Cl, og 40S.
Forskjeller mellom isoto og isotoper
Nukleidene beskriver de forskjellige typene atomkjerner som eksisterer, i henhold til mengden protoner og nøytroner de har.
På samme måte er Isotropos og isotopene mellom denne typen nukleider, som vil bli differensiert nedenfor.
Når det underskudd, så totalen er den samme. Imidlertid er atomnummeret ditt annerledes.
Det kan tjene deg: Crystalloid Solutions: Sammensetning, typer og eksemplerI denne forstand kommer de isopiske artene fra forskjellige kjemiske elementer, så de er lokalisert i forskjellige rom i det periodiske tabellen og har forskjellige egenskaper og spesifikke egenskaper.
På den annen side, i tilfelle av isotoper, skjer det motsatte, siden de har samme atomnummer, men forskjellig masse av masse; det vil si at de har samme antall protoner, men forskjellige antall nøytroner inne i atomkjernene deres.
I tillegg er isotopene atomarter som tilhører de samme elementene, så de er plassert i samme rom i det periodiske tabellen og har lignende egenskaper og egenskaper.

