Isoleucinegenskaper, funksjoner, biosyntese, mat
- 4048
- 1288
- Prof. Joakim Johansen
De isoleucin (Ile, i) er en av de 22 aminosyrene som er til stede i naturen som en del av proteiner. Med tanke på at menneskekroppen, som noen andre pattedyr, ikke kan syntetisere den, er isoleucin blant de 9 essensielle aminosyrene som må oppnås med kostholdet.
Denne aminosyren ble isolert for første gang i 1903 av forsker f. Ehrlich fra nitrogenbestanddelene av rødbeter eller rødbeter. Deretter skilte den samme forfatteren isoleucin fra nedbrytningsproduktene til fibrin og andre proteiner.
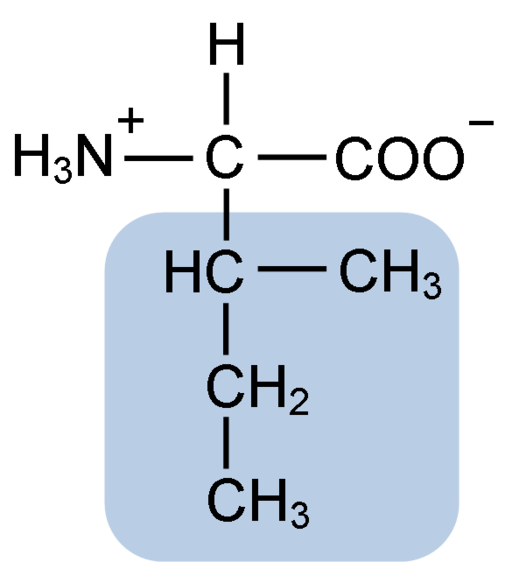
 Kjemisk struktur av isoleucinaminosyren (kilde: clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons)
Kjemisk struktur av isoleucinaminosyren (kilde: clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons) Det er en ikke -polar aminosyre som er til stede i store deler av celleproteinene fra levende organismer, i tillegg er det en del av BCAAS forgrenede aminosyrer (fra engelsk BRanched CHain TILMitt nei TILCids), Sammen med Leucina og Valina.
Den har funksjoner i etableringen av den tertiære strukturen til mange proteiner, og deltar i tillegg i dannelsen av forskjellige metabolske forløpere relatert til cellulær energimetabolisme.
[TOC]
Kjennetegn
Isoleucine er klassifisert i den ikke -polare aminosyregruppen med grupper eller kjeder av aifatisk natur, det vil si med hydrokarbon hydrokarbonkjeder.
På grunn av denne egenskapen har aminosyrene i denne gruppen som alanin, Valina og Leucina en tendens til å forbli nær hverandre, noe som bidrar til stabilisering av proteiner som er en del ved hjelp av hydrofobe interaksjoner.
Denne ikke -polare aminosyren veier omtrent 131 g/mol og er til stede i proteiner i en andel nær 6%, ofte "begravet" i midten av dem (takket være dens hydrofobe egenskaper).
Struktur
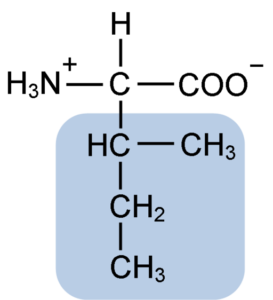
Isoleucin er en a-aminosyre som, i likhet med de andre aminosyrene, har et sentralt karbonatom kalt α (som er chiral), som fire forskjellige grupper er sammen med: et atom av hydrogen, en aminogruppe (-NH2), a karboksylgruppe (-coh) og en sidekjede eller R Grupo.
Isoleucingruppen R består av et enkelt forgrenet hydrokarbon av 4 karbonatomer (-CH3-CH2-CH (CH3)) i hvis kjede det også er et quiralt karbonatom.
På grunn av denne karakteristikken har isoleucin fire mulige måter: to av dem er de optiske isomerer kjent som L-isoleucin og D-isoleucin, og de to andre er diastereoisomerer av L-isoleucin. Den dominerende formen i proteiner er L-isoleucine.
Den molekylære formelen til isoleucin er C6H13NO2 og dets kjemiske navn er a-amino-p-metyl-p-etylpropionisk eller 2-amino-3-metyl pentatonisk surt eller syresyre.
Funksjoner
Isoleucin har flere fysiologiske funksjoner hos dyr, inkludert
- Sårheling
- Avgiftning av nitrogenavfall
- Stimulering av immunfunksjoner og
- Promotering av sekresjon av forskjellige hormoner.
Det regnes som en glykogen aminosyre, siden den fungerer som et forløpermolekyl for syntese av mellommenn i sitrushuskyssyklusen (Krebs -syklusen) som deretter bidrar til dannelse av glukose i leveren.
Av denne grunn antas det at isoleucin deltar i reguleringen av plasmaglukosenivåer, noe som har viktige implikasjoner fra kroppsenergiens synspunkt.
Isoleucin bidrar til synteseutene til glutamin og alanin, og fungerer til fordel for balansen mellom forgrenede aminosyrer.
I det kliniske feltet påpeker noen forfattere at en økning i konsentrasjoner av isoleucin, leucin, tyrosin og valin kan være karakteristiske markører av tumorberørte celler, etterfulgt av en økning i glutaminnivået.
Andre funksjoner
Ulike vitenskapelig forskning har vist at isoleucin er nødvendig for syntese av hemoglobin, proteinet som er ansvarlig for å transportere oksygen i blodet til mange dyr.
I tillegg aktiverer denne aminosyren inntreden av næringsstoffer i cellene; Noen studier avslører at den under langvarig faste er i stand til å erstatte glukose som energikilde, og i tillegg er det en ketogen aminosyre.
Det kan tjene deg: Biologi tidslinjeKetogene aminosyrer er de hvis karbonskjeletter kan lagres, for eksempel fettsyrer eller karbohydrater, slik at de jobber i energireserven.
Isoleucin og andre forgrenede kjedeaminosyrer (i tillegg til vekstfaktorer og miljøforhold) arbeider med aktivering av den hvite eller målsignaleringsveien til rapamycin, mTOR (fra engelsk mTananistisk TArget entenF RApamycin).
Denne ruten er en viktig signalvei i eukaryoter som er i stand til å kontrollere cellevekst og metabolisme, samt proteinsyntese og autofagihendelser. I tillegg kontrollerer det fremdriften i aldring og noen patologier som kreft eller diabetes.
Biosyntese
Mennesker og andre dyr klarer ikke å syntetisere isoleucin, men dette er en del av celleproteiner takket være deres anskaffelse fra maten vi konsumerer daglig.
Planter, sopp og de fleste mikroorganismer er i stand til å syntetisere denne aminosyren fra noe komplekse ruter som vanligvis er koblet sammen med andre aminosyrer som også anses som essensielle for mennesket.
Det er for eksempel måter for produksjon av isoleucin, lysin, metionin og treonin fra aspartatet.
I bakterier produseres spesifikt isoleucin fra treoninaminosyren, gjennom pyruvat, gjennom en rute som innebærer kondensasjon av 2 av pyruvatkarbonene med et molekyl av α-Ecthobutirat som stammer fra treoninet.
Reaksjonen begynner med virkningen av enzymet dehydratase, som katalyserer dehydrering av treonin for å produsere a-e-ecotobutirat og ammonium (NH3). Deretter bidrar de samme enzymene som deltar i biosyntesen av valinen til trinnene i
- Transaminering
- Oksidativ dekarboksylering av de tilsvarende ketoacidene og
- Dehydrogenering.
I denne typen mikroorganismer er syntesen av aminosyrer som lysin, metionin, treonin og isoleucin veldig koordinert og regulert, spesielt ved negativ tilbakemelding, der reaksjonsprodukter hemmer aktiviteten til enzymene som er involvert.
Selv om isoleucin, som leucin og valin, er essensielle aminosyrer for mennesket, kan aminotransferae-enzymer som er til stede i kroppsvev, innkonvertere dem reversibelt til sine tilsvarende α-Zo-stoats, noe som til slutt kan erstatte dem i kostholdet.
Nedbrytning
Som en stor del av aminosyrene som er kjent i naturen, kan isoleucin bli degradert for å danne mellommenn i forskjellige metabolske ruter, blant dem Krebs -syklusen (som gir den største mengden koenzymer som fungerer for energiproduksjon eller for biosyntese av andre forbindelser ).
Både isoleucin og tryptofan, lysin, fenylalanin, tyrosin, treonin og leucin kan brukes til å produsere acetyl-CoA, en nøkkelmetabolsk mellomledd for flere cellereaksjoner.
I motsetning til andre aminosyrer, blir ikke forgrenede aminosyrer (leucin, isoleucin og valin) degradert i leveren, men oksyderes som drivstoff i muskel, hjerne, nyrer og fettvev.
Disse organene og vevene kan bruke disse aminosyrene takket være tilstedeværelsen av et aminotransferase-enzym som er i stand til å virke på de tre og produsere deres tilsvarende aminosyre a-ZO.
Når disse oksyderte aminosyrerne derivater er produsert, katalyserer a-ZO-ketoacid enzymatisk kompleks den oksidative dekarboksyleringen av dem, der det frigjør et karbondioksidmolekyl (CO2) og produserer et acyl-CoA-derivat av aminosyrer i spørsmålet.
Patologier relatert til metabolismen av isoleucin
Feil i metabolismen av isoleucin og andre aminosyrer kan forårsake mangfold av rare og komplekse patologier som sykdommen "" "Lønnesirup urin”(Urin med arce sirup) eller forgrenet kjede ketoaciduria.
Som navnet tilsier, er denne sykdommen preget av den særegne aromaen av urinen til pasienter som lider av den, i tillegg til oppkast, anfall, psykisk utviklingshemning og for tidlig død.
Det må gjøre, spesifikt, med feil i a-cetoacid dehydrogenase enzymatisk kompleks, slik at forgrenede aminosyrer som isoleucin og dens oksiderte derivater skilles ut i urinen.
Kan tjene deg: Tafonomi: Historie, bevaring og fossil endringSammen er patologier relatert til katabolismen av forgrenede kjedeaminosyrer som isoleucin kjent som organiske acidurias, selv om de som er direkte relatert til denne aminosyren er ganske sjeldne.
Mat rik på isoleucin
Denne aminosyren er rikelig i muskelvevet til dyr, slik at kjøtt av dyr opprinnelse som ku, svinekjøtt, fisk og andre lignende som lam, kylling, kalkun, hjort, blant andre, de er rike på det samme.
Det finnes også i meieriet og dets derivater som ost. Det er i egg og også i forskjellige typer frø og nøtter, som en essensiell del av proteinene som utgjør dem.
Det er rikelig i soyabønner og erter, så vel som i ekstraktene av gjær som brukes med forskjellige matformål.
Plasmanivåene av isoleucin for et voksent menneske er mellom 30 og 108 μmol/L, for barn og unge mellom 2 og 18 år er mellom 22 og 107 μmol/L og for spedbarn mellom 0 og 2 år mellom 26 og 86 μmol/l.
Disse dataene antyder at forbruket av rik mat i denne og andre relaterte aminosyrer er nødvendig for å opprettholde mange av de fysiologiske funksjonene til organismen, siden mennesker ikke er i stand til å syntetisere den av novo.
Fordelene med inntaket ditt
Ernæringstilskudd med isoleucin inneholder vanligvis andre essensielle aminosyrer i forgrenet kjede som valin eller leucin eller annen.
Blant de vanligste eksemplene på isoleucinforbruk er ernæringstilskuddene som brukes av idrettsutøvere for å øke prosentandelen av muskelmasse eller proteinsyntese. Imidlertid diskuteres det vitenskapelige grunnlaget som denne praksis støttes, og resultatene deres er ikke helt garantert.
Isoleucin brukes imidlertid for å motvirke de metabolske effektene av vitaminmangel (Pelagra) som er karakteristiske for pasienter som har rikt sorghum og mais diett, som er mat med høyt leucininnhold, noe som kan påvirke metabolismen til tryptofan og nikotinsyre hos mennesker.
Effektene av pelagra på eksperimentelle rotter, for eksempel, involverer vekstforsinkelser, som overvinnes med isoleucintilskudd.
- I dyreproduksjonsindustrien
På området dyreproduksjon har aminosyrer som lysin, treonin, metionin og isoleucin blitt brukt i pilotprøver for å dyrke grisen i kontrollerte forhold.
Isoleucine ser spesielt ut til å ha effekter på nitrogenassimilering, selv om det ikke bidrar til vektøkningen til disse gårdsdyrene.
- Under noen kliniske forhold
Noen publikasjoner antyder at isoleucin er i stand til å redusere glukosenivået i plasma, så inntaket deres anbefales hos pasienter som lider av lidelser som diabetes eller lav insulinproduksjonshastighet.
Virusinfeksjoner
Isooleucine tilskudd har vist seg nyttig hos pasienter infisert med rotavirus som forårsaker sykdommer som gastroenteritt og diaré hos små barn og andre unge dyr.
Nyere studier konkluderer med at forbruket av denne aminosyren av eksperimentelle dyr med de nevnte egenskapene (infisert med rotavirus) hjelper til i veksten og ytelsen til det medfødte immunsystem Mønstre.
Mangelforstyrrelser
Mangelisoleucin kan bære problemer i synet, hud (som dermatitt) og tarm (tydelig som diaré og andre gastrointestinale manifestasjoner))).
Med tanke på det faktum at det er en essensiell aminosyre for dannelse og syntese av hemoglobin, så vel som for regenerering av erytrocytter (blodceller), kan alvorlige mangler i isoleucin ha alvorlige fysiologiske konsekvenser, spesielt relatert til anemi og andre hematologiske sykdommer.
Kan tjene deg: tertiære forbrukereDette er eksperimentelt demonstrert i "normale" gnagere som dårlige dietter er gitt til i dette isoleucinet, som ender med utviklingen av viktige anemiske malerier.
Imidlertid deltar isoleucin i dannelsen av hemoglobin bare hos spedbarn, siden proteinet til det voksne mennesket ikke har viktige mengder av slik aminosyre; Dette betyr at mangelen på isoleucin er tydeligere i løpet av de første utviklingsstadiene.
Referanser
- Aders plimmer, r. (1908). Proteinerens kjemiske konstitusjon. jeg dro. London, Storbritannia: Longmans, Green og CO.
- Aders plimmer, r. (1908). Proteinerens kjemiske konstitusjon. Del II. London, Storbritannia: Longmans, Green og CO.
- Barret, g., & Elmore, D. (2004). Aminosyrer og peptider. Cambridge: Cambridge University Press.
- Blau, n., Duran, m., Blaskovics, m., & Gibson, K. (nitten nittiseks). Legeveiledning til laboratoriediagnostisering av metabolske sykdommer (2. utg.).
- Bradford, h. (1931). Historien om oppdagelsen av aminosyrene. Ii. En gjennomgang av aminosyrer beskrevet siden 1931 som komponenter av naturlige proteiner. Fremskritt innen proteinkjemi, 81-171.
- Campos-Ferraz, p. L., Bozza, t., Nicastro, h., & Båt, til. H. (2013). Distinkte effekter av leucin eller en blanding av den forgrenede amininosyren (leucin, isoleucin og valin) tilskudd på motstand mot tretthet, og muskel- og lever-glykogen-nedbrytning, hos trente rotter rotter. Ernæring, 29(11-12), 1388-1394.
- Champe, s., & Harvey, r. (2003). Aminosyrer aminosyrer. I Lippincotts illustrerte anmeldelser: biokjemi (3rth Ed., pp. 1-12). Lippincott.
- Chandran, k., & Damodaran, m. (1951). Aminosyrer og proteiner i hemoglobinformasjon 2. Isoleucin. Journal Biochemical, 49, 393-398.
- Chung, a. S., & Beames, r. M. (1974). Lysin, treonin, metionin og isoleucin tilskudd av Peace River Barley for voksende griser. Hund. J. Anim. Sci., 436, 429-436.
- DeJong, c., Meijerink, w., Van Berlo, C., Deutz, n., & Soetre, s. (nitten nittiseks). Dekkede plasma -isoleucinkonsentre etter øvre gastropentiell blødning hos mennesker. MAGE, 39, 13-17.
- Edsall, J. (1960). Aminosyrer, proteiner og biokjemi for kreft (Vol. 241). London: Academic Press, Inc.
- Britannica Encyclopaedia. (2012). Hentet 30. august 2019, fra https: // www.Britannica.com/science/isoleucine
- Gelfand, r., Hendler, r., & Sherwin, r. (1979). Kostholdskarbohydrat og metabolisme av inntatt protein. Lancet, 65-68.
- Hudson, f. (1992). Biokjemi av matproteiner. Springer-Science+Business Media, B.V.
- KERR, i., Vockley, J., & Gibson, K. M. (2014). Forstyrrelser av leucin, isoleucin og valine metabolisme. I n. Blau (red.), Legeveiledning til diagnose, behandling og oppfølging av arvelige metabolske sykdommer (s. 103-141).
- Korman, s. H. (2006). Medfødte feil i isoleucinforringelse: En gjennomgang. Molekylær genetikk og metabolisme, 89(4), 289-299.
- Krishnaswamy, k., & Gpalan, c. (1971). Effekt av isoleucin på hud og elektroencefalogram i pellagra. Lancet, 1167-1169.
- Martin, r. OG., & Kirk, K. (2007). Transport av det esensielle næringsstoffet isoleucin i humane erytrocytter infisert med malariaparasittplasmodium falciparum. Blod, 109(5), 2217-2224.
- Nasjonalt senter for bioteknologiinformasjon. PubChem -database. L-isoleucine, CID = 6306, https: // pubchem.NCBI.NLM.NIH.Gov/Compund/L-isoleucine (åpnet i august. 31, 2019)
- Nuttall, f. Q., Schweim, k., & Gannon, m. C. (2008). Effekt av oralt administrert isoleucin med og uten glukose på insulin, glukagon og glukosekonsentrasjoner hos ikke-diabetiske personer. Den europeiske e-tidsskriftet for klinisk ernæring og metabolisme, 3(4), 152-158.
- Van Berlo, C. L. H., Van de Bogaard, til. OG. J. M., Van der Heijden, m. TIL. H., Van eijk, h. M. H., Janssen, m. TIL., Bost, m. C. F., & Soetre, s. B. (1989). Er utrolige ammoniakkfrigjøring etter blødning i fordøyelseskanalen innrømmelsen av fullstendig fravær av isoleucin i hemoglobin? En studie på griser. Hepatologi, 10(3), 315-323.
- Vickery, h. B., & Schmidt, c. L. TIL. (1931). Historien om oppdagelsen av aminosyrene. Kjemiske anmeldelser, 9(2), 169-318.
- Wolfe, r. R. (2017). Forgrenede aminer og muskelproteinsyntese hos mennesker: Myte eller virkelighet? Journal of the International Society of Sports Nutrition, 14(1), 1-7.
- Wu, g. (2009). Aminosyrer: Metabolisme, funksjoner og ernæring. Aminosyrer, 37(1), 1-17.

