Adsorpsjonsisotermer konsept, typer, eksempler

- 1134
- 271
- Prof. Theodor Gran
De Adsorpsjonsisotermer De er grafiske representasjoner av oppførselen til en adsorbert partikkel, på overflaten av et fast stoff eller væske, når konsentrasjonen økes. Hvis de adsorberte partiklene tilsvarer de med en gass, tas trykket i betraktning.
Ved å observere denne isotermen, kan en ide om hvordan adsorpsjonsprosessen foregår sted tas; Og derfor, hvordan er partikkeloverflateinteraksjoner og overflateegenskaper. Analyse av isotermen trekkes ut hvis overflaten er glatt, porøs eller mikroporøs, så vel som mulige kondensasjoner.
 Komponenter som er nødvendige for graf eller konstruksjon av adsorpsjonsisotermer. Kilde: Gabriel Bolívar.
Komponenter som er nødvendige for graf eller konstruksjon av adsorpsjonsisotermer. Kilde: Gabriel Bolívar. Det overordnede bildet hjelper til med å avklare de nevnte. De adsorberte partiklene (lilla sirkler) er de så -kalt adsorbater. Mens adsorbenten er det som har et område som adsorbatene vil bli adsorbert. Når trykket eller konsentrasjonen øker, jo større er adsorbert volum over adsorbenten.
Denne enkle representasjonen tilsvarer en adsorpsjon beskrevet av type I -isoterm. Ved bruk av isotermer studeres adsorpsjoner av gasser eller flytende uendelig på geler, faste stoffer eller katalysatorer.
[TOC]
Typer adsorpsjonsisotermer
 Adsorpsjonsisotermer for gassfolid systemer. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Adsorpsjonsisotermer for gassfolid systemer. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0) Fem av de viktigste eksperimentelle isotermene brukt av S er vist ovenfor. Brunauer for å klassifisere gassformige partikler på faste stoffer. Hver beskriver en annen adsorpsjonsprosess. Hver og en har også matematiske modeller som søker å utlede oppførselen til kurvene.
Indisk av hva som er enhetene eller variablene som brukes i x (p/po) og y (x) akser, indikerer x -aksen hvor mye trykk eller konvertering av adsorbat "handlinger" på det faste stoffet; Mens Y -aksen, sier hvor mye av den adsorbatet som virkelig var adsorbert på overflaten av nevnte faststoff eller adsorbent.
Det kan tjene deg: Kobbersulfat (CUSO4): Struktur, egenskaper, innhenting, brukNår vi beveger oss til høyre for x -aksen, ser vi således hvordan mengden adsorberte partikler øker avhengig av økningen i trykket eller konsentrasjonen. Dette fører til et maksimum, et forfall, en dal osv., som på en eller annen måte tillater å tolke hvordan adsorpsjon finner sted.
Type I -isoterm
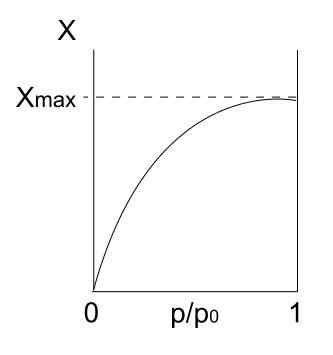 Type I -isoterm. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Type I -isoterm. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0) Vi har type I -isoterm ovenfor, som også er kjent som Langmuir -isoterm, siden modellen spådde formen på denne kurven. Ser det, tolkes det umiddelbart at det er en maksimal mengde (xmax) adsorberte partikler, som ikke vil variere uansett hvor mye trykket øker.
Denne maksimale adsorpsjonsverdien kan skyldes flere årsaker. En av dem er at det skjer et kjemisorsjon, noe som betyr at partikler eller adsorbater er sterkt bundet til overflaten av det faste stoffet eller adsorbenten. Når det ikke er mer plass på overflaten for å imøtekomme flere partikler, vil det ikke være mer adsorpsjon.
Det sies da at en monolag har dannet seg (for eksempel de lilla sirklene i det første bildet).
En annen grunn til å rettferdiggjøre isoterm av type I er at en fisisorpsjon oppstår, noe som betyr at interaksjoner mellom partikkeloverflater er veldig svake (de innebærer ikke dannelse av kjemiske bindinger).
I dette tilfellet ender partiklene opp med å komme inn i mikroporos, som en gang er fylt, vil overflaten ikke ha flere steder for følgende adsoraksjoner; Det vil si at det har lite eksternt område tilgjengelig (som om det var et veldig fint gitter). Denne oppførselen blir observert når mikroporøse pulver blir analysert.
Kan tjene deg: silisium: historie, egenskaper, struktur, innhenting, brukSkriv isoterm Ii
 Type II -isoterm. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Type II -isoterm. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0) UP har vi type II -isoterm, også kjent som Sigmoid isoterm. Dette beskriver fysisprosesser for både ikke -porøse faste stoffer og makroporøse faste stoffer.
Merk at det i begynnelsen ligner den forrige isotermen, noe som betyr at de adsorberte partiklene danner en monolag på adsorbentoverflaten. Når monolaget er klar, vil de andre partiklene bli adsorbert på toppen av førstnevnte, og gi opphav til flerlags. Dette er når vi ser den karakteristiske økningen av denne isotermen (til høyre).
En annen grunn til at type II isoterm oppnås er fordi partiklene føler større affinitet for overflaten enn seg selv. Det vil si at monolaget (partikler-superficie) vil være mer stabil og varig enn flerlags (partikler-partikler) senere.
Skriv isoterm Iii
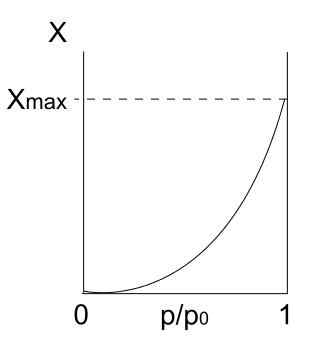 Type III isoterm. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Type III isoterm. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0) Type III -isoterm ligner på type II med hensyn til dens tolkning: multikapas og fysis. Imidlertid er denne gangen interaksjonene mellom multikapaer sterkere enn monolagets overflate med overflaten av det faste stoffet. Derfor er det en uregelmessig adsorpsjon, med hauger av adsorberte partikler og frie overflatedeler.
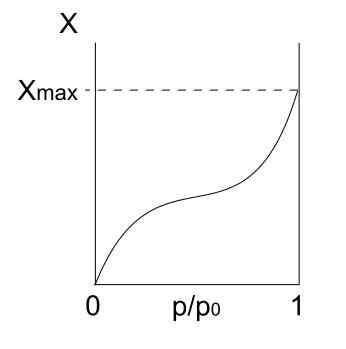
Skriv isoterm IV
 Type IV -isoterm. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Type IV -isoterm. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0) IV IV -isoterm beskriver også Fisisorpsjons- og flerlagsprosesser, og ser ut som type II -isoterm; Men nå, i porøse (og mesoporøse) faste stoffer, hvor kondensasjonen av gassformede partikler er mulig i små væskevolum. Inntil porene med væske er "dekket", vil ikke monolaget være fullført.
Kan tjene deg: Matkjemi: studieretning, elementer, applikasjonerSkriv isoterm V
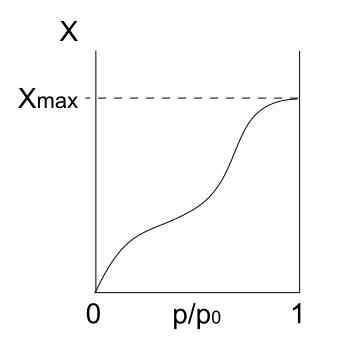
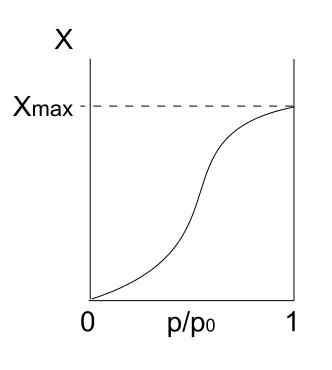 Type V isoterm. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Type V isoterm. Kilde: Daniele Pugliesi/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0) Type V -isoterm ligner på type IV, bare denne gangen er formasjonene av multikapa mer utsatt enn den respektive mono forpa. Det vil si at det ligner adsorpsjonen beskrevet av type III -isoterm. Her når multicapa en maksimal tykkelse, der det ikke er noen steder for flere partikler å adsorbere.
Eksempler
Noen eksempler på gassfolid-systemer vil bli nevnt nedenfor ved siden av typen isotermer som er oppnådd i deres eksperimentelle studier:
-Ammoniakk-karbon (type I)
-Nitrogen-zeolitter (type I)
-Hydrogen-karbon ved høye temperaturer (type I)
-Kulloksygen-Negro (type I)
-Silica nitrogen (type II)
-Nitrogen-hierro (type II)
-Silica Bromo-Gel (Type III)
-Silika joddamp (type III)
-Nitrogen-politisk (type III)
-Kripton-Negro of Coal (type IV)
-Benzen-gel av jernoksid (type IV)
-Vanndamp-karbon (type V)
Merk at de nevnte faste stoffer var kull, svart kull, metalljern, jernoksid, zeolitter og silikagel. Alle av dem er gode eksempler på adsorbenter med forskjellige industrielle applikasjoner.
Referanser
- Walter J. Moore. (1963). Fysisk kjemi. I termodynamikk og kjemisk balanse. (Fjerde utg.). Longmans.
- Iran. Levine. (2009). Prinsipper for fysikjemi. Sjette utgave, side 479-540. Mc Graw Hill.
- Glasstone. (1970). Lærebok for fysisk kjemi. Andre utgave. D. Van Nostrand, Company, Inc.
- Enhet 3. Overflatefenomener. (s.F.). Adsorpsjon. [PDF]. Gjenopprettet fra: Depa.Fquim.Unam.MX
- Lowell s., Shields J.OG. (1984) adsorpsjonsisotermer. I: Pulveroverflateareal og porøsitet. Springer, Dordrecht.
- Elsevier f.V. (2020). Adsorpsjonsisoterm. Scientedirect. Hentet fra: Scientedirect.com
- Wikipedia. (2020). Adsorpsjon. Hentet fra: i.Wikipedia.org

