Laminina -egenskaper, struktur, funksjoner, typer
- 2876
- 301
- Marius Aasen
De Laminin Det er et av proteinene som utgjør den ekstracellulære matrisen til basalmembranen til epitelvev hos virveldyr. Denne typen protein gir en bindende støtte mellom konjunktive vevsceller, slik at de fungerer i samholdet og komprimeringen av disse.
Generelt er lamininer ansvarlige for å bestille det intrikate proteintettverket som danner den ekstracellulære matrisen eller basalvevsmembranen. Vanligvis er lamininer assosiert med proteiner som kollagen, proteoglykaner, entaktiner og hepar vil sulfat.
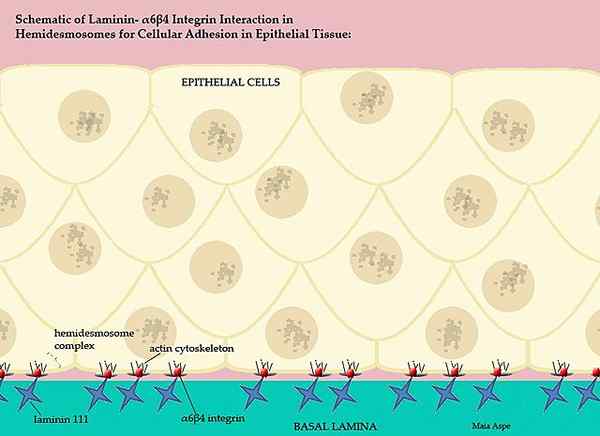
 Lamininer og deres deltakelse i basal virveldyrmembran (kilde: maiaaspe/cc BY-s (https: // creativecommons.Org/lisenser/by-SA/3.0) via Wikimedia Commons)
Lamininer og deres deltakelse i basal virveldyrmembran (kilde: maiaaspe/cc BY-s (https: // creativecommons.Org/lisenser/by-SA/3.0) via Wikimedia Commons) Denne intrikate basalmembranen, bestilt av lamininene, skiller epiteldelene av vevet, det vil si hver ekstracellulær matrise skiller endotelet fra mesototio og den ekstracellulære matrisen til mesotelito skiller dette laget fra epitelet.
Mange undersøkelser har vist at ekspresjonen av muterte lamininsgener potensielt er dødelige for en celle, siden disse også er ansvarlige for å regulere nesten alle komplekse interaksjoner som oppstår i basalmembranen.
Det er et stort mangfold av Laminins -familier i alle virveldyr. Disse varierer i sammensetning, form, funksjon og opprinnelse. I samme individ, i forskjellige vev, kan det bli funnet forskjellige lamininer, hver tilpasset omgivelsene i vevet som uttrykker det.
[TOC]
Laminina -egenskaper
Laminine monomerer eller enheter består av en annen glykoproteinkjeder heterotromer. Disse proteinene inneholder mange forskjellige domener (multidominier) og er en essensiell del av den tidlige embryonale utviklingen av vev.
Den vanlige formen for lamininer er et slags "kors" eller "y", selv om noen har en lang barform med fire konsekvenser. Denne lille variasjonen tillater hver type laminin regelmessig tilstrekkelig integrasjon fra enhver posisjon i vevet.
Det kan tjene deg: P-nitrofenol: Kjennetegn, bruk og toksisitetLamininer har høy molekylvekt, som kan variere avhengig av type laminin, fra 140 til 1000 kDa.
Generelt har hver basalmembran en eller flere forskjellige typer lamininer inne, og noen forskere foreslår at lamininer bestemmer en stor del av den fysiologiske funksjonen til basalmembranene i vevet der de blir funnet.
Hos virveldyr er det funnet minst 15 forskjellige typer lamininer, klassifisert i en familie, siden de er dannet fra samme trimmer, men med forskjellige kombinasjoner. Hos virvelløse dyr har de funnet mellom 1 og 2 forskjellige trimmer.
Aktuelle studier antyder at lamininer av alle virveldyr oppsto gjennom differensiering av ortologer, det vil si at alle gener som koder for lamininer har et vanlig opphav fra virvelløse dyr.
Struktur
Til tross for det store antallet funksjoner som regulerer lamininer, har de en ganske enkel struktur som for det meste er bevart blant de forskjellige typene som er kjent.
Hver laminin består av tre forskjellige kjeder sammenvevd med hverandre og danner en slags "sammenvevd fiber". Hver av de tre kjedene er identifisert som ALFA (α), Beta (β) og gamma (γ).
Dannelsen av trimeren til hvert laminin avhenger av foreningen av den C-terminale regionen i hver av dens kjeder. Inne.
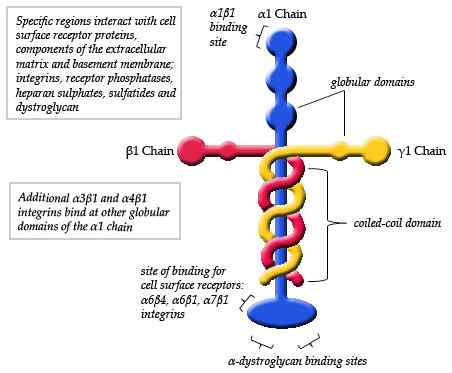 Skjematisk diagram over strukturen til en laminin (kilde: maiaaspe/cc by-sa (https: // creativecommons.Org/lisenser/by-SA/3.0) via Wikimedia Commons)
Skjematisk diagram over strukturen til en laminin (kilde: maiaaspe/cc by-sa (https: // creativecommons.Org/lisenser/by-SA/3.0) via Wikimedia Commons) Observasjonene gjort ved elektronisk mikroskopi av de typiske lamininmonomerer har detaljert at strukturen er et slags asymmetrisk kryss som har en lang arm på omtrent 77 nm (nanometer) som er preget av en fremtredende kuleform i en av dens ender.
Kan tjene deg: BefolkningsdynamikkI tillegg blir tre korte armer observert, to av omtrent 34 nm og en av omtrent 48 nm. Hver arm ender i en kuleenden, lik hovedkjeden, men mindre i størrelse.
Forskjellen mellom de forskjellige typene lamininer skyldes hovedsakelig forskjeller i α -kjeder, som kan brettes på minst tre forskjellige måter; Selv om varianter for alle kjeder for øyeblikket er identifisert:
- 5 forskjellige variasjoner eller kjeder av laminin α
- 3 varianter av β -kjeder
- 3 varianter for γ -kjeder
Funksjoner
Den viktigste og ofte studerte funksjonen til lamininer er interaksjonen med reseptorene som er forankret i cellemembranene i cellene ved siden av basalmembranene der disse er funnet.
Denne interaksjonen gjør at disse proteinene skal være involvert i regulering av flere cellulære aktiviteter og signaluter. Det skyldes at funksjonene deres avhenger av deres interaksjon med spesifikke reseptorer på celleoverflaten (mange av membranreseptorene er for øyeblikket klassifisert i henhold til deres evne til forening til lamininer).
Integriner er reseptorene som interagerer med "ikke -integrin" lamininer og reseptorer er de som ikke har evnen til å slå sammen disse proteinene. De fleste av de "ikke -integrin" reseptorene er proteoglykaner, noen dystroglykanere eller syndekanoer.
Modning av vevene i kroppsorganene finner sted med en erstatning av tidlige lamininer, som opprinnelig ble innlosjert i basalmembranen i vevene som dannet ungdomsorganene.
Innenfor lamininene er den typen som har blitt studert mest laminin-1, som er direkte knyttet til veksten av aksoner av praktisk talt alle typer nevroner under forhold In vitro, Siden de regulerer bevegelsen av "vekstkjeglen" på overflaten av nevronene.
Kan tjene deg: Urea -buljong: Hva er, grunnlag, forberedelse, brukNomenklatur og typer
Biokjemister anser familien av lamininer som en veldig stor proteinfamilie, hvorav få av medlemmene fremdeles er kjent. Imidlertid vil moderne verktøy tillate at nye typer lamininer kan skimtes.
Slike proteiner identifiseres hver med et tall, og starter med 1 avslutter nummereringen i 15 (laminin-1, laminin-2 ... laminina-15).
En annen type nomenklatur brukes også, noe som indikerer hvilken type kjede som hver laminin har. For eksempel er laminin -11 sammensatt av en ALFA (α) -5 -kjede, av en beta -kjede (β) -2 og av en gammakjede (γ) -1, så den kan kalles laminina -521.
I tillegg er hvert laminin klassifisert i henhold til funksjonen som er assosiert med den er assosiert med, og også i henhold til det spesifikke kroppsvevet der det deltar. Noen eksempler på lamininer er:
- Lamina-1: som deltar i epitelutvikling
- Laminina-2: involvert i den myogene utviklingen av alle vev, det perifere nervesystemet og Glomerulus-matrisen.
- Lamina-3: Delta i mine tendinøse fagforeninger
- Lamina-4: Fungerer i nevromuskulære fagforeninger og i mesangialmatrisen til Glomeruli
- Laminina-5, 6 og 7: De virker helst i epidermal vev.
Referanser
- Miner, J. H., & Yurchenco, s. D. (2004). Lamininfunksjoner i vevsmorfogenese. Annu. Rev. Cell Dev. Biol., 20, 255-284.
- Rasmussen, d. G. K., & Karsdal, m. TIL. (2016). Lamininer. I biokjemi av kollagener, lamininer og elastin (PP. 163-196). Akademisk presse.
- Sasaki, t., Fässler, r., & Hohenester, og. (2004). Laminin: kjellermembranenheten i kjelleren. The Journal of Cell Biology, 164 (7), 959-963.
- TIMPL, r., Engel, J., & Martin, G. R. (1983). Multifunksjonelt laminin-A-protein av kjellermembraner. Trender i biokjemiske vitenskaper, 8 (6), 207-209.
- TIMPL, r., Rohde, h., Robey, s. G., Rennard, s. Yo., Foidart, J. M., & Martin, G. R. (1979). Laminin-A glykoprotein fra kjellermembraner. Journal of Biological Chemistry, 254 (19), 9933-9937.
- Tryggvason, k. (1993). Lamininfamilien. Nåværende mening i cellebiologi, 5 (5), 877-882.

