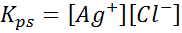Masseaksjonslov

- 4171
- 827
- Prof. Theodor Gran
 En nedbørreaksjon innebærer balansen mellom løselighet, som styres av masseaksjonsloven
En nedbørreaksjon innebærer balansen mellom løselighet, som styres av masseaksjonsloven Hva er masseaksjonsloven?
De Masseaksjonslov sier at hastigheten på en reaksjon avhenger av konsentrasjonen av reaktantene som er hevet til dens støkiometriske koeffisienter. Denne loven gjør det mulig å forholde seg til hverandre konsentrasjonene i balansen mellom reaktantene og produktene fra en reversibel kjemisk reaksjon. Med andre ord, den etablerer formelen til likevektskonstanten.
Masseaksjonsloven ble gitt av de norske (og kremen) kjemikerne Cato m. Guldberg (1836-1902) og Peter Waage (1833-1900) i 1864. Dette er en av de grunnleggende lovene om kjemi, siden det lar oss beregne de endelige konsentrasjonene i likevekt fra de første mengdene.
I tillegg til dette tillater masseloven oss også å forstå effekten av endringer i konsentrasjonene til noen av artene i balanse. Med andre ord, det lar oss forstå hvordan Le Chatliers prinsipper fungerer.
Til tross for å bli kalt "masseaksjonslov", refererer det egentlig ikke til massene til reaktantene og produktene, men snarere til deres konsentrasjoner. Årsaken som kalles masseaksjonslov og ikke handlingsloven er fordi konsentrasjonen pleide å bli kalt "aktiv masse".
Masseaksjonsloven og likevektskonstanten
I henhold til masseaksjonsloven, når reversible reaksjoner når balanse, er det ikke fordi reaksjonen stopper. Tvert imot, balansen nås når hastigheten på den direkte reaksjonen blir gjort lik hastigheten på den omvendte reaksjonen. Når det skjer, oppstår alle kjemiske arter og konsumert med samme hastighet, så konsentrasjonene deres blir konstante (de slutter å endre seg).
Kan tjene deg: toluen: struktur, egenskaper, bruk, innhentingGuldberg og Waage oppdaget at hastighetene til begge reaksjonene (direkte og inverse) avhenger av den molare konsentrasjonen (i mol/l) av reagensene deres løftet til støkiometriske koeffisienter. Fra disse observasjonene klarte de å finne formelen for likevektskonstanten.
I henhold til denne loven, for enhver reversibel kjemisk reaksjon som når balanse,
“… Forholdet mellom produktet av de molare konsentrasjonene av produktene som ble hevet til deres støkiometriske koeffisienter og produktet av de molare konsentrasjonene av reaktantene som er hevet til deres støkiometriske koeffisienter er konstant ved en viss temperatur.""
Denne konstanten kalles "likevektskonstant" og er representert med K -symboletc.
Likevektskonstant formel
La oss se hvordan den forrige uttalelsen ser ut i form av en matematisk ligning. Det er en reversibel kjemisk reaksjon som den som er presentert nedenfor, hvor A og B er reaktantene, C og D produktene, og A, B, C og D er de respektive støkiometriske koeffisientene til den balanserte reaksjonen:
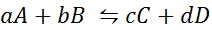
For en generisk reaksjon som denne er likevektskonstanten gitt av:
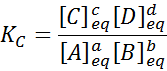
hvor [a], [b], [c] og [d] er de molare konsentrasjonene av a, b, c og d i balanse.
Balansekonstanten i presset
Den forrige formelen for likevektskonstanten gjelder enhver kjemisk reaksjon der alle stoffer er i samme fase (det vil si at de alle er i vandig fase, eller i en gassfase, for eksempel). I tilfelle av gassfase -reaksjoner er det imidlertid mer praktisk å jobbe med trykk enn med konsentrasjoner.
Ettersom den molære konsentrasjonen av gasser er proporsjonal med deres delvise trykk, kan formelen for likevektskonstanten skrives om i form av disse trykket, som følger:
Det kan tjene deg: 30 bruk av karboksylsyrer i hverdagen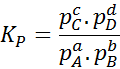
Hvor pTIL, pB, pC Og sD De er det delvise trykket til henholdsvis A, B, C og D, og A, B, C og D forblir de støkiometriske koeffisientene. I dette tilfellet, kP Det kalles den konstante balansen i trykk, og er relatert til kC Gjennom følgende formel:
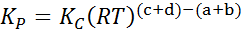
Hvor R er den universelle konstanten av ideelle gasser og T er den absolutte temperaturen i Kelvin.
Reaksjoner som involverer mer enn en fase
Noen ganger involverer en kjemisk reaksjon dannelse av et fast stoff som et bunnfall fra en løsning, eller dannelse av en væske fra reaktanter som reagerer i en gassfase. I disse tilfellene skjer ikke reaksjonen i samme fase, så vi må endre likevektskonstantformelen.
Heldigvis er modifikasjoner veldig enkle. Det eneste vi må ta hensyn til når vi skriver formelen til likevektskonstanten, er at de rene stoffene som vises som faste stoffer eller væsker ikke skal ta dem med i betraktningen. I stedet plasserer vi i stedet en 1.
Avslutningsvis tillater masseaksjonsloven å skrive formelen til likevektskonstanten både i konsentrasjoner og i delvis trykk. Når du kjenner den ene av de to, kan den andre bli funnet fra den første.
Til slutt må vi være forsiktige og gjennomgå fasen der alle kjemiske arter blir funnet, for å vite om vi må inkludere dem i likevektskonstanten eller ikke eller ikke.
Eksempler på bruken av masseaksjonsloven
I de følgende eksempler viser vi hvordan vi bruker masseaksjonsloven til å skrive formlene for likevektskonstanter for forskjellige typer kjemiske reaksjoner.
Reaksjoner av reaksjoner i gassformig tilstand
Eksempel 1: Nedbrytningen av n2ENTEN4 I en gassfase
Deretter2ENTEN4 Det er en brun gass som brytes sammen i henhold til følgende reaksjon:
Det kan tjene deg: Láuric Acid: Struktur, egenskaper, bruksområder, fordeler, effekter
 NO2 -prøve ved forskjellige temperaturer som viser forskyvningen av balansen til den brune N2O4
NO2 -prøve ved forskjellige temperaturer som viser forskyvningen av balansen til den brune N2O4 For denne reaksjonen er likevektskonstantene i konsentrasjoner og trykk gitt av:
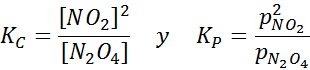
Eksempel 2: Oksidasjonen av karbonmonoksid
Karbonmonoksid er en veldig giftig gass som kan bli karbondioksid når du reagerer med oksygen i henhold til følgende reaksjon:
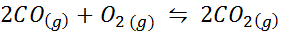
For denne reaksjonen er likevektskonstantene i konsentrasjoner og trykk gitt av:
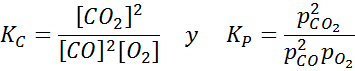
Syre-base balanser i vandig fase
Eksempel 3: Vann selvlengde
Den ioniske vannbalansen, også kjent som vann -lengde -reaksjonen, er en reversibel reaksjon mellom to vannmolekyler i en flytende tilstand. Reaksjonen er:
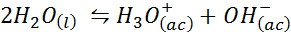
Når vi skriver likevektskonstanten for denne reaksjonen, må vi ta hensyn til at i dette tilfellet er det eneste reagenset en ren væske hvis konsentrasjon er praktisk talt konstant. Av denne grunn er det ikke inkludert i formelen til likevektskonstanten:
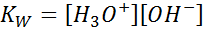
Dette er en veldig viktig likevektskonstant som får sitt eget navn (konstant av det ioniske vannproduktet) og sitt eget symbol (kW. W refererer til vann på engelsk, som sies toalett). Imidlertid er det en konstant av balanse i konsentrasjoner som alle andre.
Løselighetsbalanser
Eksempel 4: Sølvkloridløselighetsbalanse
Når vi utarbeider en mettet løsning, etableres en løselighetsbalanse. I dette tilfellet er balansen den for oppløsningen av sølvklorid, hvis reaksjon er gitt av:
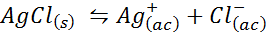
Likevektskonstanten for denne reaksjonen (og av alle løsningsreaksjoner) inkluderer ikke sølvklorid (AGCL) siden den er et fast stoff. I tillegg, som i tilfelle av vann, får disse konstantene også et spesielt navn som er "konstant av løselighetsproduktet", representert som k$: