Dobbelt substitusjonsreaksjon
- 3615
- 1033
- Jonathan Carlsen
Vi forklarer hva en dobbel substitusjonsreaksjon er, typene som eksisterer og gir flere eksempler
Hva er en dobbel substitusjonsreaksjon?
De Dobbelt substitusjonsreaksjon, av dobbel forskyvning eller metese, er det en der en dobbel utveksling av ioner oppstår mellom to forbindelser, uten at noen av disse er oksidert eller redusert. Det utgjør en av de mest elementære kjemiske reaksjonene.
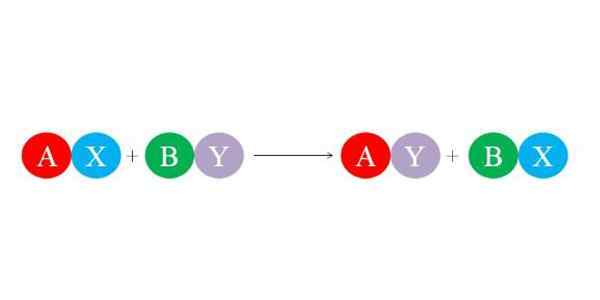
De nye koblingene dannes av de store elektrostatiske attraksjonskreftene mellom ionene. På samme måte favoriserer reaksjonen dannelsen av de mest stabile artene, for eksempel vannmolekylet, hovedsakelig. I det nedre bildet er den generelle kjemiske ligningen for den doble substitusjonsreaksjonen illustrert.

De første forbindelsene øks og ved å reagere ved å utveksle "deres partnere" og dermed danne to nye forbindelser: ay og bx. Denne reaksjonen kjører hvis og bare hvis E og er mer relatert enn A og B, eller hvis BX -koblingene er mer stabile enn av av av. Siden reaksjonen er en enkel ionebytte, vinner ingen av disse eller mister elektronene (redoksreaksjon).
Så hvis A er en lastekation +1 i øksforbindelsen, vil den ha samme belastning +1 i forbindelsen AY. Det samme gjelder resten av "bokstavene". Denne typen reaksjoner er støtte fra syre-base og stupbratte dannelsesreaksjoner.
Typer dobbeltsubstitusjonsreaksjoner
Nøytralisering
En sterk syre reagerer med en sterk base for å produsere oppløselige salter og vann. Når en av de to - syren eller basen - er svak, er ikke saltet som produseres fullstendig ionisert; det vil si i vandig medium som er i stand til å hydrolysere. På samme måte kan syre eller base nøytraliseres med et salt.
Kan tjene deg: Beryl Oxide (Beeo)Ovennevnte kan representeres igjen av den kjemiske ligningen med Axby -bokstaver. Siden Brønsteds surhet bare er indikert av H -ioner+ Og åh-, Disse kommer til å representere bokstavene til E Y:
HX + BOH => HOH + BX
Denne kjemiske ligningen tilsvarer nøytralisering, som ganske enkelt er reaksjonen mellom en HX -syre og en Boh -base for å produsere HOH (H2O) og BX -saltet, som godt kan være løselig eller ikke i vann.
Skjelettet ditt kan variere i henhold til støkiometriske koeffisienter eller syreens natur (enten det er organisk eller uorganisk).
Nedbør
I denne typen reaksjoner er et av produktene uoppløselige i midten, generelt vandig og utfeller (sedimenter det faste stoffet i resten av løsningen).
Ordningen er som følger: to oppløselige forbindelser, øks og av, og et av produktene, AY eller BX, bunnfall, som vil avhenge av løselighetsreglene:
Ax + av => ay (S) + BX
Ax + av => ay + bx (s)
I tilfelle at både AY og BX var uoppløselige i vann, vil det føre til at paret av ioner som presenterer de sterkeste elektrostatiske interaksjonene, som kan reflekteres kvantitativt i dets løselighetskonstante verdier (KPs).
I de fleste nedbørreaksjoner er imidlertid et salt løselig og de andre utfellingene. Begge reaksjonene - nøytralisering og nedbør - kan oppstå i samme blanding av stoffer.
Eksempler på dobbeltsubstitusjonsreaksjoner
Eksempel 1
HCl (AC) + NaOH (AC) => H2Eller (l) + NaCl (AC)
Hva slags reaksjon er dette? Saltsyre reagerer med natriumhydroksyd som genererer vann og natriumklorid som en konsekvens. Fordi NaCl er veldig løselig i vandig medium, og at et vannmolekyl også ble dannet, er reaksjonen i eksempel 1 nøytralisering.
Kan tjene deg: benzen: historie, struktur, egenskaper, derivater, brukEksempel 2
Stemple3)2(AC) + Na2S (ac) => cus (er) + 2nano3(AC)
I denne reaksjonen er de ikke til stede selv ionet h+ Ikke engang OH-, Og heller ikke vannmolekylet på høyre side av den kjemiske ligningen.
Kobbernitrat (II), eller kuprisk nitrat, utveksler ioner med natriumsulfid. Kobbersulfid er uoppløselig, utfellende i motsetning til natriumnitrat, saltoppløselig.
Løsningen av Cu (nei3)2 Det er blåaktig, mens Na's2S er gulaktig. Når begge er blandede, forsvinner fargene og cus utfeller, noe som er en svartaktig.
Eksempel 3
Ch3COOH (AC) + NaOH (AC) => CH3Poon (AC) + H2Eller (l)
Igjen, dette er en annen nøytraliseringsreaksjon. Eddiksyre reagerer med natriumhydroksyd for å danne natriumacetatsalt og et vannmolekyl.
I motsetning til eksempel 1, er natriumacetat ikke et salt som er totalt ionisert, siden anion er hydrolysert:
Ch3COO-(AC) + H2Eller (l) cho3COOH (AC) + OH-(AC)
Eksempel 4
2Hi (AC) + Caco3(S) => H2Co3(AC) + CAI2(AC)
I denne reaksjonen - som selv om den ikke ser ut til å være nøytralisering - reagerer iarhydronsyren fullstendig med kalksteinen for å generere kullsyre og kalsiumjodid. I tillegg dekomponerer varmeavløsning (eksoterm reaksjon) kullsyre i karbondioksid og vann:
H2Co3(ac) => co2(g) + h2Eller (l)
Den globale reaksjonen gjenstår:
2Hi (AC) + Caco3(S) => CO2(g) + h2Eller (l) + CAI2(AC)
På samme måte nøytraliserer kalsiumkarbonat, basisk salt, iarklorsyre.
Eksempel 5
Agno3(AC) + NaCl (AC) => AgCl (S) + Nano3(AC)
Kan tjene deg: putrescina: struktur, egenskaper, syntese, brukSølvnitratutvekslinger med natriumklorid, og danner dermed uoppløselig sølvkloridsalt (hvitt bunnfall) og natriumnitrat.
Eksempel 6
2H3Po4(AC) + 3CA (OH)2(AC) => 6H2Eller (l) + ca3(Po4)2(S)
Fosforsyre nøytraliseres ved kalsiumhydroksyd, og danner følgelig det uoppløselige kalsiumfosfatsalt og seks mol vannmolekyler.
Dette er et eksempel på en dobbel substitusjonsreaksjon av begge typer: syre nøytralisering og nedbør av et uoppløselig salt.
Eksempel 7
K2S (AC) + MGSO4(ac) => k2SW4(AC) + MGS (S)
Kaliumsulfid reagerer med magnesiumsulfat, samles i løsninger S -ioner2- og mg2+ For å danne uoppløselig magnesiumsulfid og saltløselig kaliumsulfat.
Eksempel 8
Na2S (AC) + HCl (AC) → NaCl (AC) + H2S (g)
Natriumsulfid nøytraliserer saltsyre, genererer natriumklorid og hydrogensulfid.
I denne reaksjonen dannes ikke vann (i motsetning til de vanligste nøytraliseringene), men det ikke -elektrolytiske molekylhydrogensulfid, hvis lukt av råtne egg er veldig ubehagelig. H2S slipper unna løsningen i en gassform, og resten av arten forblir oppløst.

