Avogadro Law
- 3978
- 239
- Prof. Theodor Gran
Hva er Avogadros lov?
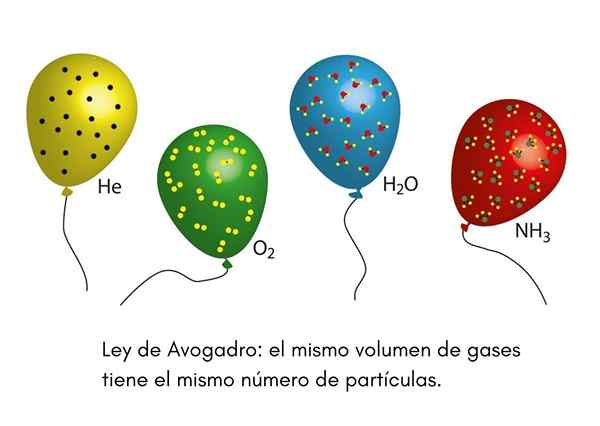
De Avogadro Law, Også kalt Avogadro -prinsippet, det er en lov som gjelder ideelle gasser og ble uttalt av en vitenskapsmann fra nittende århundre kalt Amadeo Avogadro. Denne loven slår fast at to like volum av forskjellige gasser som er i samme temperatur- og trykkforhold, vil inneholde samme antall gasspartikler.
Dette betyr at hvis vi har to ballonger, en full med helium og den andre med oksygen, og begge ballonger har samme volum, samme trykk og samme temperatur, så vil det være samme antall gassformige heliumatomer i den første klode som oksygenmolekyler i sekundet.
Avogadro Law Formula
En annen måte å staten Avogadros lov er å si at hvis konstant trykk og temperatur opprettholdes, vil volumet av en gass være proporsjonalt med antall føflekker. Dette er representert på en matematisk måte som:
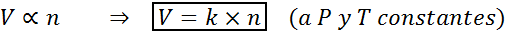
Denne formelen kan omorganiseres til v/n = k, det vil si at forholdet mellom volumet og antall føflekker forblir konstant når P og T er konstant.
Så hvis vi introduserer eller fjerner en viss mengde gass fra en beholder som holder P og T konstant, vil volumet endre seg og den innledende og endelige tilstanden vil være relatert ved hjelp av følgende ligning:

Forhold som Avogadros lov er oppfylt
Denne loven gjelder nøyaktig ideelle gasser. Dette er gasser dannet av spesifikke partikler (som ikke okkuperer et volum i rommet) som ikke samhandler med hverandre på noen måte.
Det kan tjene deg: Biodiesel: Historie, egenskaper, typer, fordeler, ulemperSom navnet tilsier, eksisterer ikke denne typen gase i virkeligheten, men i vår fantasi. De er en forenklet "idé" om det vi mener er en gass. Imidlertid er det noen forhold som en ekte gass, som luft, oppfører seg ideelt: ved veldig lavt trykk og ved veldig høye temperaturer.
Det lave trykk fører til at volumet okkupert av gasspartiklene er ubetydelige sammenlignet med størrelsen på beholderen, mens de høye temperaturene gjør at partiklene beveger seg så raskt at de ikke har tid til å samhandle når de krysser hverandre.
Under disse forholdene oppfyller de fleste gasser Avogadros lov med god nøyaktighet.
Viktigheten av Avogadros lov
Et av de viktigste bidragene fra Avogadros lov var at det tillot å demonstrere eksistensen av elementære gasser dannet av mer enn ett atom som o2 eller h2. Dette bidro til atomteoriens fremgang.
I tillegg kompletterer Avogadros lov lovene til Boyle, Charles og Gay-Lussac, og kombinerer den med disse tre lovene, tillater Avogadros lov loven om ideelle gasser, en av de viktigste lovene innen kjemi.
På den annen side tillater Avogadros lov også å etablere sammenhenger mellom molekylvekter av forskjellige gasser, siden det innebærer at massen av like volum av forskjellige gasser målt ved samme temperatur og trykk, er proporsjonal med massen til hver partikkel av hver gass.
Kan tjene deg: natriumnitrat (nano3): struktur, egenskaper, bruksområder, risikoSå med enkelt beklagelsesprøver av to gasser som okkuperer volumer som tilsvarer samme temperatur og trykk, kan forholdet mellom molmassene oppnås.
Eksempler på Avogadros lov i hverdagen
Festballonger
Vi har noen gang sett en klovn på et barnefest som blåser opp heliumballonger for å distribuere dem blant barna. Disse ballongene har omtrent samme temperatur. Hvis to festballonger er fylt med samme trykk og begge har samme størrelse, sikrer Avogadros lov at begge ballongene vil ha samme antall helium -føflekker.
På den annen side, hvis en av ballongene er større enn den andre, vil den ha et større volum, og i henhold til Avogadros lov vil den ha en større mengde heliumpartikler inne i.
Dekkene til en bil
Uansett hvilken gass de er fylt, blir dekkene på motsatte sider av en bil alltid fylt til samme slutttrykk på rundt 32 psi.
I tillegg sikrer vi alltid at begge gummiene er de samme, så de vil ha samme volum. I følge Avogadro -prinsippet kan vi således si at begge dekkene vil inneholde samme antall gassformede partikler.
En sprøyte full av luft
Anta at vi har en åpen sprøyte og full av 50 cm3 av luft. Som det er åpent, er det indre av sprøyten og det ytre (omgivelsene) på samme temperatur og trykk.
Anta nå at vi trykker på sprøytemplareren og flytter den til 10 cm er lest3. Når sprøyten blir avdekket, slipper luften gjennom spissen når stempelet beveger seg, så antallet luftpartikler inne i sprøyten avtar sammen med volumet.
Kan tjene deg: flyktiggjøringSiden verken trykket eller temperaturen endres, kan Avogadro -loven brukes for å relatere det endelige volumet til mengden luftpartikler som forblir inne i sprøyten. Dette forholdet er:

Omorganiserer denne ligningen, får vi det:
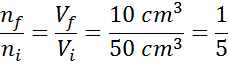
Dette resultatet betyr at hvis vi reduserer volumet inne i sprøyten til den femte, og holder P og T konstant, vil antallet mol eller partikler som er til stede inne på slutten av prosessen også være den femte delen av det som opprinnelig hadde.


