Beer-Lambert Law
- 4315
- 25
- Markus Fredriksen
Hva er øl-lambes lov?
De Beer-Lambert Law (Beer-Bouguer) er en som relaterer absorpsjonen av elektromagnetisk stråling av en eller flere kjemiske arter, med dens konsentrasjon og avstanden som renner lyset i interaksjonen. Denne loven samler to lover i en.
Bouguer's lov (selv om anerkjennelse har falt mer om Heinrich Lambert), slår fast at en prøve vil absorbere større stråling når dimensjonene til det absorberende eller materielle miljøet er større; Spesifikt dens tykkelse, som kommer til å være avstanden l som går gjennom lyset når du kommer inn og går ut.
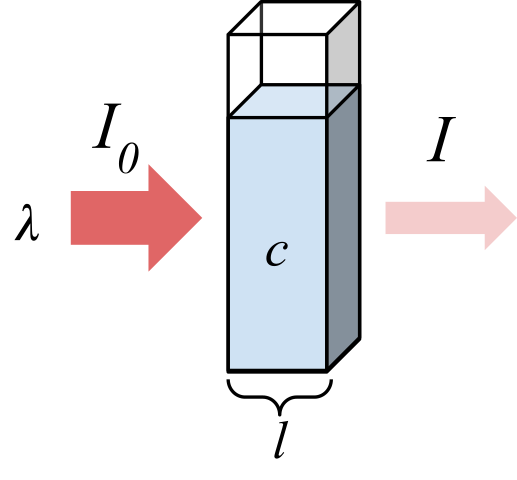 Stråling absorbert av en prøve. Kilde: Marmot2019 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons
Stråling absorbert av en prøve. Kilde: Marmot2019 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons Det overordnede bildet viser absorpsjon av monokromatisk stråling; det vil si sammensatt av en enkelt bølgelengde, λ. Det absorberende mediet er inne i en optisk celle, hvis tykkelse er l, og inneholder kjemiske arter med en konsentrasjon c.
Lysstrålen har en innledende og endelig intensitet, utpekt med symboler i0 og jeg henholdsvis. Legg merke til at etter å ha samhandlet med det absorberende mediet, er jeg mindre enn jeg0, som viser at det var strålingsabsorpsjon. Jo eldre de er c og l, mindre vil være jeg med hensyn til jeg0; det vil si at det vil være mer absorpsjon og mindre overføring.
Forklaring av øl-Lambes lov
Det overlegne bildet omfatter denne loven perfekt. Strålingsabsorpsjon i en prøve øker eller reduserer eksponentielt avhengig av c enten l. For å la loven fullstendig og lett forstås, er det nødvendig å grensene til dens matematiske aspekter.
Som nettopp nevnt, jeg0 Og jeg er intensitetene til den monokromatiske lysstrålen før og etter lys, henholdsvis. Noen tekster foretrekker å bruke P -symboler0 og P, som henviser til strålingsenergi og ikke til sin intensitet. Her vil forklaringen fortsette å bruke intensitetene.
Kan tjene deg: acetofenonFor å linearisere ligningen for denne loven, må logaritmen brukes, vanligvis basen 10:
Logg (i0/I) = εlc
Begrepet (jeg0/I) indikerer hvor mye intensiteten av strålingsproduktet av absorpsjon reduseres. Lamberts lov vurderer bare L (εl), mens ølens ignorerer L, men steder c I stedet (εc). Den høyere ligningen er foreningen av begge lover, og er derfor det generelle matematiske uttrykket for øl-lambe lov.
Absorbans og transmittans
Absorbans er definert av begrepet log (i0/Yo). Dermed uttrykkes ligningen som følger:
A = εlc
Hvor ε er ekstinksjonskoeffisienten eller molar absorganitet, noe som er en konstant ved en viss bølgelengde.
Legg merke til at hvis tykkelsen på absorberingen forblir konstant, akkurat som ε, er absorbansen til å avhenge utelukkende av konsentrasjon c, av absorberende arter. I tillegg er det en lineær ligning, y = mx, hvor og er en, og x er c.
Når absorbansen øker, avtar overføringen; Dette er, hvor mye stråling klarer å overføres etter absorpsjon. De er derfor inverse. Ja0/Jeg indikerer graden av absorpsjon, i/i0 Det er lik transmittans. Å vite dette:
Jeg/i0 = T
(Yo0/I) = 1/t
Logg (i0/I) = log (1/t)
Men logg (jeg0/I) Det er også lik absorbans. Så forholdet mellom og T er:
A = log (1/t)
Og anvende egenskapene til logaritmene og vite at log1 er lik 0:
A = -logt
Vanligvis uttrykkes overføringer i prosenter:
%T = i/i0∙ 100
Grafer
Som nevnt ovenfor, tilsvarer ligningene en lineær funksjon; Derfor forventes det at når de grafer dem, vil de gi en linje.
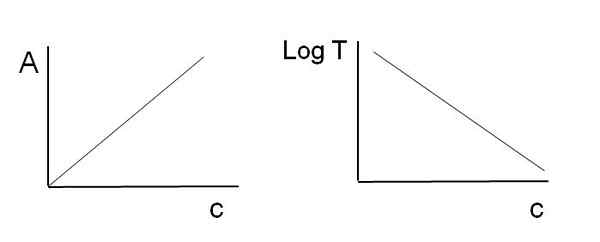
Kan tjene deg: Hva er kjemisk kinetikk? Grafikk brukt til øl-Lambert Law. Kilde: Gabriel Bolívar
Grafikk brukt til øl-Lambert Law. Kilde: Gabriel Bolívar Merk at til venstre for bildet over har du linjen oppnådd når du graferer mot c, og til høyre linjen som tilsvarer LOGT -grafen mot c. Den ene har en positiv skråning, og den andre negative; Jo større absorbans, jo lavere er overføringen.
Takket være denne lineariteten kan konsentrasjonen av de absorberende kjemiske (kromoforer) artene bestemmes om det er kjent hvor mye stråling de absorberer (a), eller hvor mye stråling den blir overført (logt). Når denne lineariteten ikke blir observert, sies det at den står overfor et avvik, positivt eller negativt, av øl-Lamberts lov.
Beer-Lambe Law Applications
Generelt sett er noen av de viktigste anvendelsene av denne loven nevnt nedenfor:
-Hvis en kjemisk art har farge, er den en eksemplarisk kandidat som skal analyseres ved kolorimetriske teknikker. Disse er basert på øl-Lambert-lov, og gjør det mulig å bestemme konsentrasjonen av analyttene basert på absorbans oppnådd med et spektrofotometer.
-Det gjør det mulig å bygge kalibreringskurvene, som tar hensyn til prøvematriseeffekten, konsentrasjonen av arten av interesse bestemmes.
-Det er mye brukt til å analysere proteiner, siden flere aminosyrer har viktige absorpsjoner i det ultrafiolette området av det elektromagnetiske spekteret.
-Kjemiske reaksjoner eller molekylære fenomener som innebærer en endring i fargelegging, kan analyseres ved absorbansverdier, ved en eller flere bølgelengder.
-Å lage multivariat analyse, komplekse kromofore -blandinger kan analyseres. På denne måten kan konsentrasjonen av alle analytter bestemmes, og også klassifisere blandinger og skille dem fra hverandre; For eksempel, utelukke om to identiske mineraler kommer fra det samme spesifikke kontinentet eller landet.
Kan tjene deg: sterk syreLøste øvelser
Oppgave 1
Hva er absorbansen av en løsning som presenterer en overføring på 30% til en bølgelengde på 640 nm?
For å løse det, bare gå til definisjonene av absorbans og transmittans.
%T = 30
T = (30/100) = 0,3
Og å vite at A = -logt, beregningen er direkte:
A = -log 0,3 = 0,5228
Merk at du mangler enheter.
Oppgave 2
Hvis oppløsningen av året før består av en art w hvis konsentrasjon er 2,30 ∙ 10-4 M, og forutsatt at cellen har en tykkelse på 2 cm: hva som skal være dens konsentrasjon for å oppnå en 8% transmittans?
Det kan løses direkte med denne ligningen:
-LOGT = εlc
Men verdien av ε er ukjent. Derfor må det beregnes med de tidligere dataene, og det antas at de forblir konstant i et bredt spekter av konsentrasjoner:
ε = -logt/lc
= (-Log 0,3)/ (2 cm x 2,3 ∙ 10-4 M)
= 1136,52 m-1∙ CM-1
Og nå kan du fortsette å beregne med %t = 8:
C = -LOGT/εl
= (-Log 0,08)/ (1136,52 m-1∙ CM-1 x 2cm)
= 4,82 ∙ 10-4 M
Deretter er det nok at W -arten dobler konsentrasjonen (4,82/2,3) for å redusere transmittansprosenten på 30% til 8%.
Referanser
- Beer-Lambert-loven. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Beer-Lambert-loven. Gjenopprettet fra: Chemguide.co.Storbritannia
- « Sosial darwinisme hva er, egenskaper, forfattere, konsekvenser
- Konsekvenser av stormer og orkaner i økosystemet »

