Charles Law -formler og enheter, eksperiment, øvelser

- 3426
- 1000
- Prof. Joakim Johansen
De Charles Law eller av Guy-Lussac er en som tillater uttalelse om en av egenskapene til gassformens tilstand: volumet som en gass opptar er direkte proporsjonal med temperaturen ved konstant trykk.
Denne proporsjonaliteten er lineær for alle temperaturer hvis den aktuelle gassen er ideell; Konge gasser, derimot, avviker fra den lineære trenden ved temperaturer nær kondensasjonspunktet. Dette har imidlertid ikke begrenset bruken av denne loven for uendelige applikasjoner der gasser deltar.
 Kinesiske lykter eller ønsker. Kilde: Pxhere.
Kinesiske lykter eller ønsker. Kilde: Pxhere. En av par excellence of Charles lov er tilstedeværelse i aerodynamiske ballonger. Andre enklere ballonger, for eksempel ønsker, også kalt kinesisk lampe.
Hvorfor konstant trykk? For hvis trykket økte, ville det bety at beholderen der gassen ligger tett lukket; Og med dette ville kollisjonene eller virkningene av gasspartiklene mot de indre veggene i nevnte beholder (Boyle-Maleotte Law) øke kollisjonene eller virkningene av de interne partiklene (Boyle-Maleotte Law).
Derfor ville det ikke være noen endring i volumet okkupert av gass, og Charles lov ville ikke være strenghet. I motsetning til en hermetisk beholder, representerer vevet i ballongene i ønsker.
Når ballongvevet utvides, forblir det indre trykket på gassen imidlertid konstant fordi det øker området som partiklene kolliderer. Jo høyere gasstemperatur, jo større er den kinetiske energien til partiklene, og derfor antall kollisjoner.
Og når kloden utvides igjen, forblir kollisjoner mot sine indre vegger konstant (ideelt sett).
Så jo varmere gassen er, jo større er utvidelsen av kloden og jo mer vil den stige. Resultatet: Rød (selv om farlige) lyser suspendert på himmelen om nettene desember.
[TOC]
Hva er Charles lov?
Uttalelse
Den såkalte Charles-loven eller Gay-Lussacs lov forklarer avhengigheten som eksisterer mellom volumet okkupert av en gass og verdien av dens absolutte temperatur eller kelvin-temperatur.
Loven kan bli utsatt som følger: Hvis trykket forblir konstant, blir det oppfylt at "for en gitt masse av en gass, øker det volumet med 1/273 ganger omtrent volumet til 0 ºC, for hver gradsentigrade (1 ºC ) som øker temperaturen ".
Arbeidsplasser
Forskningsarbeidene som tillot å etablere loven ble initiert på 1780-tallet av Jacques Alexander Cesar Charles (1746-1823). Charles publiserte imidlertid ikke resultatene av undersøkelsene hans.
Deretter klarte John Dalton i 1801 å eksperimentelt bestemme at alle gasser og damper, studert av ham, utvides mellom to bestemte temperaturer i samme volum. Disse resultatene ble bekreftet av Gay-Lussac i året 1802.
Forskningsverkene til Charles, Dalton og Gay-Lussac, tillot å fastslå at volumet okkupert av en gass og dens absolutte temperatur er direkte proporsjonal. Derfor er det et lineært forhold mellom temperaturen og volumet på en gass.
Det kan tjene deg: metoder for separasjon av heterogene blandingerKurve
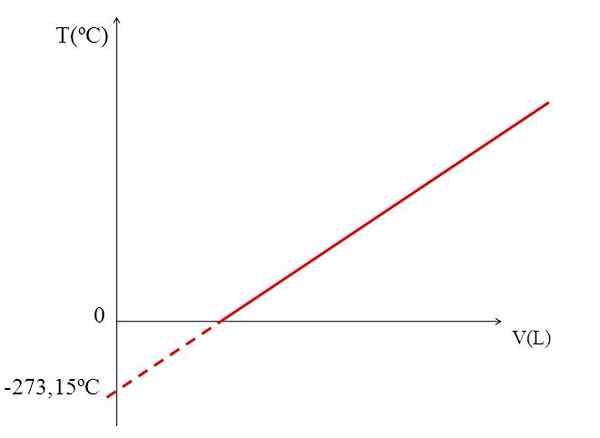 T vs V -graf for en ideell gass. Kilde: Gabriel Bolívar.
T vs V -graf for en ideell gass. Kilde: Gabriel Bolívar. Realiseringen av en graf (øvre bilde) av volumet av en gass mot temperaturen gir en rett linje. Skjæringspunktet mellom linjen med aksen til x, ved temperaturen 0 ºC, gjør det mulig å oppnå gassvolumet ved 0 ºC.
På samme måte ville skjæringspunktet mellom linjen med xen til x, gi informasjon om temperaturen som volumet okkupert av gassen ville være null "0". Dalton estimerte denne verdien til -266 ºC, nær verdien som Kelvin er foreslått for absolutt (0) Absolute.
Kelvin foreslo en temperaturskala hvis null skulle være temperaturen som en perfekt gass ville ha et volum på null. Men ved disse lave temperaturene er gassene flytende.
Det er grunnen til at vi ikke kan snakke om volum av gasser som sådan, og finner ut at verdien for absolutt null skal være -273,15 ºC.
Formler og måleenheter
Formler
Charles lov i sin moderne versjon indikerer at volumet og temperaturen på en gass er direkte proporsjonal.
Så:
V / t = k
V = gassvolum. T = Kelvin -temperatur (k). K = proporsjonalitet konstant.
For et bind V1 og en temperatur t1
k = v1 / T1
Også for et bind V2 og en temperatur t2
k = v2 / T2
Deretter matcher de to ligningene for K du har
V1 / T1 = V2 / T2
Denne formelen kan skrives som følger:
V1 · T2 = V2 · T1
Clearing v2, Formelen er oppnådd:
V2 = V1 · T2 / T1
Enheter
Gassvolumet kan uttrykkes i liter eller i noen av dens avledede enheter. På samme måte kan volumet uttrykkes i kubikkmeter eller i en hvilken som helst avledet enhet. Temperaturen må uttrykkes i absolutt temperatur eller kelvin -temperatur.
Så hvis temperaturene til en gass uttrykkes i Celsius eller Celsius skala, for å utføre en beregning med dem, bør mengden på 273,15 ºC tilsettes temperaturer, for å ta dem til absolutte temperaturer eller Kelvin.
Hvis temperaturene kommer til uttrykk i grader Farenheit, bør det tilsettes disse temperaturene 459,67 ºR, for å bringe dem til absolutte temperaturer på Rankine -skalaen.
En annen kjent formel for Charles lov, og direkte relatert til uttalelsen, er som følger:
Vt = Venten (1 + t/273)
Hvor vt Det er volumet okkupert av en gass ved en viss temperatur, uttrykt i liter, CM3, etc.; og venten Det er volumet okkupert av en gass ved 0 ºC. For sin del er T temperaturen som volummålingen gjøres, uttrykt i Celsius (ºC) grader (ºC).
Og til slutt representerer 273 den absolutte nullverdien på Kelvin -temperaturskalaen.
Eksperiment for å demonstrere loven
Montering
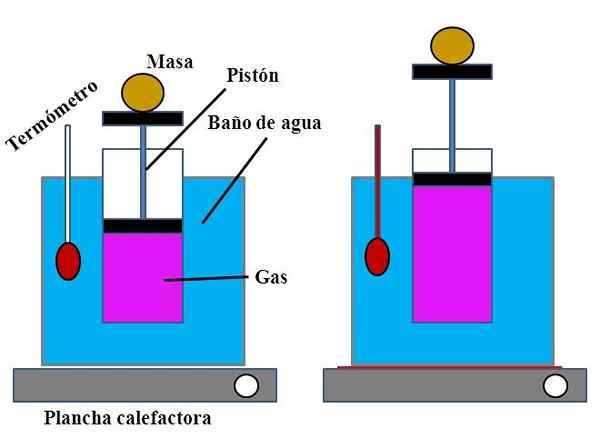 Forsamling av eksperimentet for å demonstrere Charles 'lov. Kilde: Gabriel Bolívar.
Forsamling av eksperimentet for å demonstrere Charles 'lov. Kilde: Gabriel Bolívar. I en vannbeholder, som oppfylte funksjonen til et vannbad, ble en åpen sylinder plassert av den øvre delen, med en stempel som justerte seg til den indre veggen i sylinderen (overlegen bilde).
Dette stempelet (dannet av stempelet og de to svarte basene) kunne bevege seg til den øvre eller nedre delen av sylinderen avhengig av volumet av gass den inneholdt.
Vannbadet kan varmes opp ved å bruke en lettere eller varmeanlegg, som ga varmen som var nødvendig for å øke baderomstemperaturen og derfor temperaturen på sylinderen utstyrt med en stempel.
Kan tjene deg: kalsiumhydroksyd (Ca (OH) 2): struktur, egenskaper, innhenting, brukPå stempelet ble en viss masse plassert for å sikre at eksperimentet ble utført ved konstant trykk. Bad- og sylindertemperaturen ble målt ved å bruke et termometer plassert i vannbadet.
Selv om sylinderen sannsynligvis ikke hadde en konfirmasjon for å visualisere luftvolumet, kunne dette estimeres ved å måle høyden som massen plassert på stempelet og overflaten av sylinderbasen.
Utvikling
Volumet av en sylinder oppnås ved å multiplisere overflaten av basen med høyden. Overflaten på sylinderbasen kan oppnås ved å bruke formelen: S = Pi x r2.
Mens høyden oppnås ved å måle avstanden fra sylinderens base, til stempelet som deigen hviler på.
Ettersom baderomstemperaturen økte med varme produsert av lighteren, ble det observert at stemplet steg inne i sylinderen. Deretter leste de temperaturen i vannbadet i termometeret, som tilsvarte det indre av sylinderen.
De måler også høyden på deigen på stempelet, og kan estimere luftvolumet som tilsvarte den målte temperaturen. På denne måten foretok de flere temperaturmålinger og estimater av luftvolumet som tilsvarer hver av temperaturene.
Dette kan endelig slå fast at volumet okkupert av en gass er direkte proporsjonalt med temperaturen. Denne konklusjonen tillot å oppgi den såkalte Charles -loven.
Globo med is om vinteren
I tillegg til det forrige eksperimentet, er det en enklere og mer kvalitativ: den av ballongen med is om vinteren.
Hvis om vinteren en ballong full av helium i et rom med oppvarming ble plassert, ville kloden ha et visst volum; Men hvis den deretter ble flyttet til utsiden av huset med lav temperatur, vil det bli observert at heliumballongen krymper, og reduserer volumet i henhold til Charles lov.
Løste øvelser
Oppgave 1
Du har en gass som opptar et volum på 750 cm3 ved 25 ºC: Det som vil være volumet som denne gassen opptar ved 37 ºC hvis det konstante trykket opprettholdes?
Det er nødvendig å først transformere temperaturenhetene til Kelvin:
T1 I grader Kelvin = 25 ºC + 273,15 ºC = 298,15 K
T2 I grader Kelvin = 37 ºC + 273,15 ºC = 310,15 K
Fordi det er kjent v1 og de andre variablene, det tømmer v2 Og det beregnes med følgende ligning:
V2 = V1 · (T2 / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Oppgave 2
Det som vil være temperaturen i grader Celsius som 3 liter en gass skal varmes opp til 32 ° C, slik at volumet utvides til 3,2 liter?
Igjen blir Celsius -grader i Kelvin transformert:
T1 = 32 ºC + 273,15 ºC = 305,15 K
Og som i forrige øvelse, blir T ryddet2 I stedet for v2, og beregner deretter:
T2 = V2 · (T1 / V1)
= 3,2 l · (305,15 k / 3 l)
= 325.49 k
Men uttalelsen ber om grader Celsius, så enheten til T endres2:
T2 I grader Celsius = 325, 49 ºC (k) - 273,15 ºC (k)
Kan tjene deg: Pascal sprøyte= 52,34 ºC
Øvelse 3
Hvis en gass ved 0 ºC opptar et volum på 50 cm3, Hvilket volum vil det okkupere på 45 ºC?
Bruke den opprinnelige formelen for Charles lov:
Vt = Venten (1 + t /273)
Fortsett med å beregne Vt direkte når du disponerer alle variabler:
Vt = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (k))
= 58,24 cm3
På den annen side, hvis problemet løses ved å bruke strategien til eksempler 1 og 2, vil vi ha:
V2 = V1 · (T2 / T1)
= 318 k · (50 cm3 / 273 K)
= 58,24 cm3
Resultatet, å anvende de to prosedyrene, er det samme fordi de til slutt er basert på samme prinsipp i Charles Law.
applikasjoner
WISEE GALLS
Ballongene av ønsker (allerede nevnt i introduksjonen) er utstyrt med et tekstilmateriale impregnert med en brennbar væske.
Når brann skyter dette materialet, er det en økning i lufttemperaturen i kloden, noe som forårsaker en økning i gassvolumet i henhold til Charles lov.
Derfor, ved å øke volumet av luften i kloden, reduseres luftens tetthet i den, noe som er gjort mindre enn tettheten av den omkringliggende luften, og det er grunnen til at kloden stiger opp.
Pop-up termometre eller kalkuner
Som indikert med navnet blir de brukt under matlaging av kalkuner. Termometeret har en beholder full av lukket luft med lokk og er kalibrert på en slik måte at når du når den optimale koketemperaturen, løftes lokket ved å avgi en lyd.
Termometeret er plassert inne i kalkunen, og når temperaturen øker inne i ovnen, utvides luften inne i termometeret, og øker volumet. Så når luftvolumet når en viss verdi, får det til at termometeret løft.
Gjenoppretting av formen av ping-pong-baller
Ping-pong-baller avhengig av kravene til bruken av dem, har en lett vekt og plastveggene deres er lite tykke. Dette gjør dem påvirket av racketene lider deformasjoner.
Ved å plassere de deformerte ballene i varmt vann, blir luften inni oppvarmet og utvidelsen skjer, noe som fører til en økning i luftvolumet. Dette forårsaker også en strekning av veggen til ping-pong-ballene, som tillater utvinning av sin opprinnelige form.
Utdyping av PAES
Gjær er integrert i hvetemel som brukes til å lage brød og ha muligheten til å produsere karbondioksidgass.
Ved å øke temperaturen på brødet under matlagingen øker volumet av karbondioksid. Det er på grunn av dette at en utvidelse av brødet oppstår til ønsket volum er nådd.
Referanser
- Clark J. (2013). Oter Gas Laws - Boyle's Law and Charles 'Law. Gjenopprettet fra: Chemguide.co.Storbritannia
- Staroscik Andrew. (2018). Charles 'lov. Hentet fra: Scientprimer.com
- Wikipedia. (2019). Charles Law. Hentet fra: i.Wikipedia.org
- Helmestine, Todd. (27. desember 2018). Hva er formelen for Charles 'lov? Gjenopprettet fra: Thoughtco.com
- Prof. N. Av løve. (s.F.). Elementary Gas Laws: Charles Law. C 101 KLASSE NOTER. Gjenopprettet fra: iun.Edu
- Briceño Gabriela. (2018). Charles Law. Gjenopprettet fra: Euston96.com
- Morris, J. G. (1974). Fysikjemi for biologer. (2gir utgave). Redaksjonell tilbakevending, S.TIL.
- « Fjorten poeng med Wilson -bakgrunn og hvordan det påvirket Tyskland
- Anvendelser av begrepene energi, kraft, styrke, arbeid »

