Henrys lov

- 2248
- 474
- Jonathan Carlsen
 Henrys lov forklarer bruken av brus
Henrys lov forklarer bruken av brus Hva er Henrys lov?
De Henrys lov Det er forholdet som beskriver effekten av trykk på gassløselighet. Denne loven slår fast at løseligheten av en gass i kontakt med overflaten til en væske ved en gitt temperatur er direkte proporsjonal med det delvise trykket til nevnte gass på væsken.
Dette betyr at jo større gasstrykk på en væske, jo større er den totale mengden gass som kan oppløses i den, og dermed oppnå en større konsentrasjon (det vil si, desto større er løseligheten).
Henrys lov Vi ser det i aksjon hver gang vi avdekker en brusdrink. Å være lukket, høyt trykk inne i flasken holder kullsgass oppløst. Men ved å avdekke det, avtar gasstrykket, noe som reduserer løseligheten og slipper ut som danner bobler og brus.
Henrys lovformel
I matematisk form uttrykkes Henrys lov som en lov om proporsjonalitet:
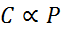
Denne proporsjonalitetsloven blir omgjort til:
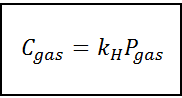
Hvor C Det refererer til den maksimale konsentrasjonen av gass i væsken, det vil si dens løselighet; Pgass Det er det delvise trykket av gass i kontakt med væsken og kH Det er en proporsjonalitetskonstant kalt Henrys lov konstant.
Gasskonsentrasjon kan uttrykkes i forskjellige enheter som molaritet, føflekk eller molar fraksjon. I de fleste tilfeller bruker kjemikalier imidlertid konsentrasjon i molaritetsenheter (i mol/l), mens trykket kommer til uttrykk i atmosfærer.
Kan tjene deg: Antracen: Hva er, struktur, egenskaper, brukKonstanten i Henrys lov (kH)
Konstanten kH Beskrive interaksjonene mellom en gass og et løsningsmiddel. Jo sterkere disse interaksjonene er, jo større er konstant, og desto større er løseligheten av gassen i løsningsmidlet ved en viss temperatur og trykk.
Numerisk, verdien av kH representerer løseligheten av gassen ved den gitte temperaturen, når delvis trykket av det samme er 1 atm.
Avhengig av enhetene for konsentrasjon og trykk som brukes i ligningen, kan denne konstanten ha mol/l enheter.atm, mol/kg.minibank osv.
Følgende tabell viser verdiene for konstanten av Henrys lov for noen vanlige gasser i vann ved 25 ° C:

Disse verdiene avtar med temperaturen, siden løseligheten av gasser generelt synker ved en høyere temperatur.
Forklaring av Henrys lov
Henrys lov er veldig lett å forstå fra det mikroskopiske synspunktet. Vi kan forestille oss en gass som et sett med veldig små partikler som spretter på alle overflatene som spiller. Når de kolliderer med overflaten til en væske, vil noen partikler sprette, mens andre vil krysse overflaten som blir fanget (det vil si at de vil oppløses).
Det samme gjelder gasspartikler som er oppløst. De spretter med veggene i beholderen og kan også nå overflaten av væsken, hvor noen vil sprette mens andre vil krysse overflaten og rømme til gassfasen.
Når balansen oppnås, er hastighetene som gassen oppløses i løsningsmidlet og som den slipper unna dem er like, så konsentrasjonen forblir konstant.
Kan tjene deg: Mekaniske egenskaper til metaller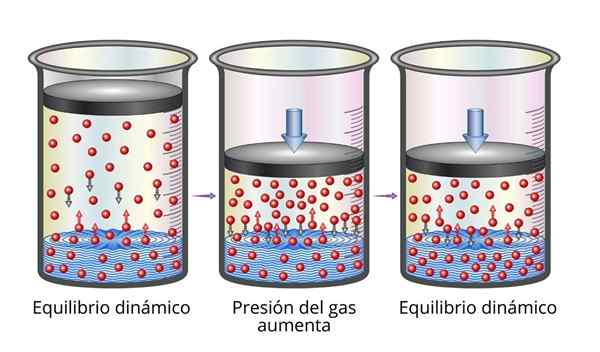 Forklaring av Henrys lov
Forklaring av Henrys lov Når vi øker gasstrykket, er det vi gjør å øke frekvensen som gasspartikler kolliderer med væskeoverflaten. Dette gjør hastigheten som gassen oppløses øker. Når en ny balanse oppnås, vil den nye konsentrasjonen av gass være større.
Unntak fra Henrys lov
Det er viktig å fremheve at Henrys lov er en ideell lov, som bare beskriver oppførselen til reelle gassløsninger under visse forhold. Dermed kan Henrys lov bare brukes når:
- Temperaturen forblir konstant.
- Gassen er i balanse med løsningen.
- Gasstrykket er relativt lavt.
- Gassen reagerer ikke med løsningsmidlet.
Til tross for dette, selv i noen tilfeller der gassen reagerer med løsningsmidlet, kan denne loven brukes omtrent.
Eksempler på anvendelse av Henrys lov
Eksempel 1: Bestemmelse av konstanten av Henrys lov
Det ble eksperimentelt bestemt at konsentrasjonen av en vandig løsning i balanse med neon ved et trykk på 3,00 atm og 25 ° C er 0,00135 mol/l. Bestem konstanten i Henrys lov for neon i vann ved 25 ° C.
Løsning:
I henhold til Henrys lov:
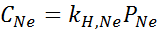
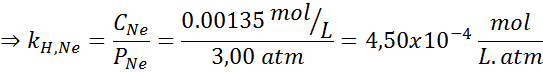
Derfor er Henrys lov konstant for neon i vann ved 25 ° C 4,50 × 10-4 mol/l.ATM.
Eksempel 2: Bestemmelse av løseligheten av en gass
Ved å bruke konstanten i Henrys lov gitt i forrige tabell, må du bestemme løseligheten av karbondioksid i luften i vann ved havnivå, vel vitende om at den molære fraksjonen av nevnte gass i luften er 3,14 × 10-4.
Løsning:
Ved havnivå er lufttrykket 1 atm, og det delvise trykket til CO2 Det er gitt av:
Det kan tjene deg: Hypoyodous acid (HIO)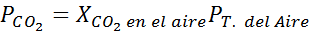
Erstatte dette uttrykket i Henrys lov:
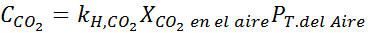
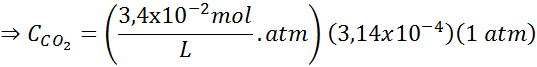
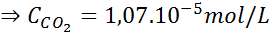
Eksempel 3: Dykkegasser
Når en dykker ingenting på dybder større enn 30 meter, må en blanding av luft puste med andre inerte gasser som helium eller argon, siden økningen i nitrogenkonsentrasjon i det forutsagte blodet etter Henrys lov har narkotiske effekter som forårsaker desorientering, forvirring og syn problemer.
Denne effekten begynner å observere når du puster luft (xN2= 0,78) med et trykk på 4,00 atm. Hvis en dykker planlegger å stige opp til 100 meter dyp, der trykket er rundt 11,0 atm, hva er den maksimale nitrogenfraksjonen som kan puste før du lider av narkotikasmuglerne?
Løsning:
Basert på uttalelsen kan vi utlede at den maksimale konsentrasjonen av nitrogen er det som oppstår når lufttrykket er 4,00 atm. I henhold til Henrys lov og ved å bruke forholdet mellom totalt press og delvis press fra det forrige eksemplet:
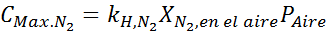
Dette må være den samme maksimale konsentrasjonen ved et hvilket som helst totalt trykk. Så 100 meter:
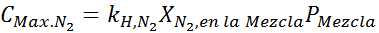
Utjevning av begge ligningene kan vi finne den maksimale molære fraksjonen av nitrogen i blandingen:
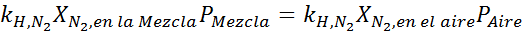
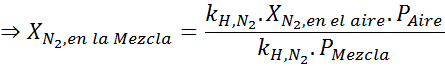
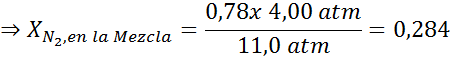
Dette betyr at dykkeren ikke skal bruke en blanding som inneholder mer enn 28,4% nitrogen hvis den planlegger å dykke opp til 100 meter dyp.

