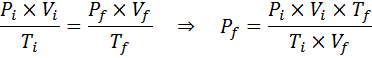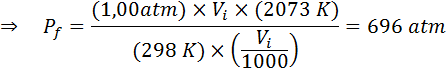General Gases Law

- 4010
- 1142
- Prof. Theodor Gran
Hva er den generelle gassloven?
De General Gases Law, Noen ganger også kalt den kombinerte gassloven, er det kombinasjonen av Boyle's Laws, Charles og Gay-Lussac. Det er en lov som beskriver forholdet mellom trykket, temperaturen og volumet av en fast mengde av en ideell gass.
Uttalelsen av denne loven sier:
“Hvis antall mol av en gass er konstant, forblir forholdet mellom trykkvolumet og temperaturproduktet konstant konstant.""
I matematisk form uttrykkes den generelle gassloven som følger:
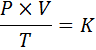
Der P representerer trykket på gassen, V dets volum, t sin absolutte temperatur og k er en konstant av proporsjonalitet, hvis verdi avhenger av både mengden nåværende gass og enhetene der de andre variablene er uttrykt.
Alternative former for den generelle gassloven
Som en proporsjonalitetslov
En alternativ måte å utgjøre den generelle gassloven er i form av en proporsjonalitetslov på:
"For en hvilken som helst fast mengde av en gass, er produktet av trykket og volumet direkte proporsjonalt med temperaturen".
Dette betyr at:
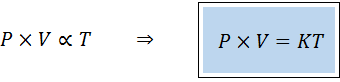
Dette tilsvarer å multiplisere begge medlemmene av den første ligningen etter temperatur.
Forholdet mellom den første og endelige tilstanden
I likhet med lovene til Boyle, Charles og Gay-Lussac, kan den generelle gassloven uttrykkes som et forhold mellom den opprinnelige tilstanden og den endelige tilstanden til en gass som gjennomgår en statsendring.
I motsetning til de tidligere lovene, er det ikke nødvendig at ingen av de tre variablene forblir konstante, bare antall føflekker. Det vil si at PXV/T -forholdet vil være det samme i starttilstanden, Yo, Og i den endelige tilstanden, F. Med andre ord, den generelle gassloven kan også uttrykkes matematisk som:
Det kan tjene deg: Píchric Acid: Hva er, struktur, syntese, egenskaper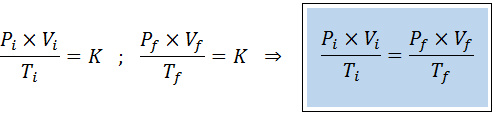
Avledning av formelen til den generelle gassloven
Som nevnt ovenfor, kommer den generelle gassloven fra kombinasjonen av Boyle, Charles og Gay-Lussacs lover. Disse lovene er presentert nedenfor:
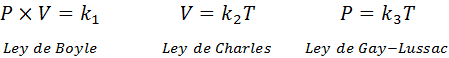
Hvis vi fra hver av disse lovene fjerner konstanten k, Og så multipliserer vi dem med hverandre, vi får:
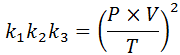
Nå, som tar kvadratroten i begge medlemmer, oppnås den generelle gassloven:
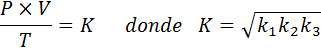
Den generelle gassloven vs. Loven om de ideelle gassene
Loven om generelle gasser med den ideelle gassloven skal ikke forveksles. Til tross for at han er to veldig like og også nært beslektede lover, kombinerer den generelle gassloven bare lovene til Boyle, Charles og Gay-Lussac.
For sin del tilfører den ideelle gassloven Avogadro -prinsippet, hvorfra "Like volum av forskjellige gasser målt under samme temperatur- og trykkforhold, inneholder samme antall partikler ”.
Som en konsekvens, i tillegg til å relatere temperatur, volum og trykk, tillater loven om ideell gass også disse variablene å være relatert til antall partikler eller molene til en gass, så det representerer tilstandsligningen for statusen til Ideelle gasser.
I de følgende ligningene kan forskjellen mellom disse to lovene lettere observeres:

Merk at hovedforskjellen mellom begge lovene er at den ideelle gaseloven inkluderer n, som representerer antall føflekker, og også i stedet for konstanten K, har Den konstante r som er konstanten av de ideelle gassene.
Kan tjene deg: terpenosVi kan si at den ideelle gassloven er mer generell enn den generelle gassloven, siden den kan brukes for en hvilken som helst mengde av en gass under ethvert sett med trykk, temperatur og volumforhold. På den annen side krever anvendelsen av den generelle gassloven at mengden gass forblir konstant.
Eksempler på anvendelsen av den generelle gassloven
Nedenfor er noen eksempler på typiske problemer der den generelle gassloven kan brukes:
Eksempel 1: En luftboble undervann
Anta at en dykker som er på en dybde på 20 m under vann der trykket er 3,00 atm og temperaturen er 15 ° C, frigjør et pust av luft og en av boblene har et innledende volum på 100 cm3.
Bestem volumet på luftboblen når den når overflaten som er i standard temperatur- og trykkforhold, forutsatt at mengden luft inne i boblen ikke endres når den stiger.
Løsning
Først må vi hente ut alle dataene fra uttalelsen. Det er underforstått at det er to forskjellige tilstander for gass, en første og en ende, så vi skiller dataene i to grupper. Det er også nødvendig å konvertere temperaturer ved absolutt temperatur:

Ettersom problemet spesifiserer at det ikke er noen endring i mengden gass (luften), kan vi bruke den generelle gassloven, hvorfra vi kan fjerne det endelige volumet:
Kan tjene deg: Rodio: Historie, egenskaper, struktur, bruk, risiko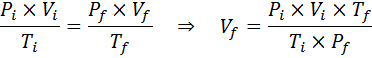
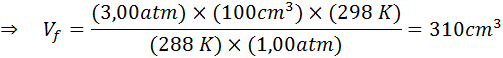
Derfor når luftboblen et volum på 310 cm3 Når du når overflaten.
Eksempel 2: høyt trykk
Hvor mye vil trykket fra en ideell gass som er ved en omgivelsestemperatur på 25 ° C og et trykk på 1,00 atm og komprimere tusenvis av volumet samtidig varme opp til 1800 ° C i en forseglet beholder?
Løsning
Som før starter vi med å trekke ut dataene:

Som det sier at prosessen utføres i en forseglet beholder, endres ikke mengden gass, slik at den generelle gassloven kan brukes: