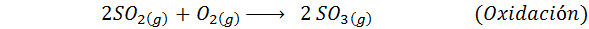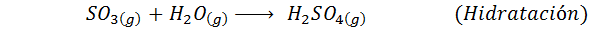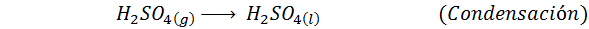Svovelsyre (H2SO4)

- 973
- 235
- Marius Aasen
Vi forklarer hvilken svovelsyre, dens kjemiske struktur, egenskaper, hvordan den oppnås, bruksområder og risiko
 Svovelsyrebåter (H2SO4)
Svovelsyrebåter (H2SO4) Hva er svovelsyre?
Han svovelsyre, Også kalt hydrogensulfat og vitriololje, det er en oksacid svovelsyre dannet av svovelanhydridreaksjonen (så3) og vann. Den molekylære formelen er h2SW4 Og det er langt den mest produserte og brukte mineralsyre.
Det er en sterk og meget etsende mineralsyre som er blandbar med vann, slik at den kan fremstilles i form av oppløsninger av nesten enhver konsentrasjon mellom 0 og rundt 18 molar.
De høye volumene av produksjon og forbruk av denne forbindelsen skyldes dens flere anvendelser i bransjer som var så variert som landbruk, den petrokjemiske industrien, i organisk og uorganisk syntese og i behandlingen av avløpsvann, for bare å nevne noen bare noen.
Svovelsyrestruktur
Svovelsyre dannes av et sentralt svovelatom med Valencia VI som er omgitt av 4 oksygenatomer, hvorav to er knyttet til hydrogenatomer. Lewis -strukturen er presentert nedenfor:
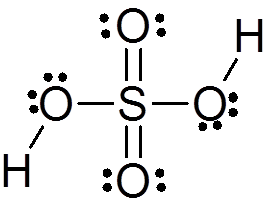
Som du kan se, er svovel i denne forbindelsen omgitt av 12 elektroner (6 par), så den representerer et av unntakene av oktettregelen.
Å være omgitt av 4 atomer, spår teorien om frastøtning av elektronparene i Valencia (TREPEV) at denne forbindelsen må anta en omtrent tetrahedral geometri, som er vist i følgende bilde:
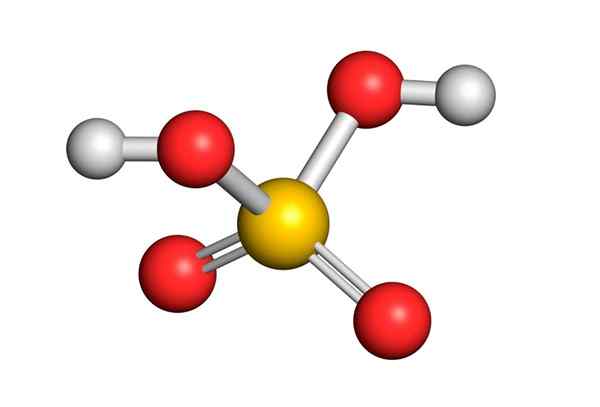
På grunn av den høye elektronegativiteten til oksygen og de forskjellige resonansstrukturene som svovelsyre kan ha, er bindinger mellom oksygen og hydrogener sterkt polariserte, noe som gjør dem veldig sure og enkle å dissosiere hydrogener.
Svovelsyreegenskaper
Som en konsekvens av dens struktur har svovelsyre følgende fysiske og kjemiske egenskaper:
Det kan tjene deg: Epoksyd: nomenklatur, innhenting, applikasjoner, eksemplerFysiske egenskaper
- Ren svovelsyre er en fargeløs og toalettvæske som har en tetthet på 1.8302 g/ml.
- Smeltepunktet er 10,31 ° C og kokingen er 337 ° C, selv om den ved den temperaturen har en tendens til å dekomponere for å produsere vann og svovelanhydrid (også kalt svoveltrioksid).
- Det er helt blandbar med vann, slik at du kan tilberede løsninger med enhver konsentrasjon. Imidlertid er løsninger med mer enn 98,3% i masse av denne syren ustabile og syre dekomponerer til konsentrasjonen avtar til 98,3%. Denne løsningen er stabil og er det som kalles konsentrert svovelsyre.
- I sin rene eller konsentrerte tilstand er det en mer tyktflytende væske enn vann.
Kjemiske egenskaper
- Ren svovelsyre er et sterkt oksidant og etsende stoff. Den har evnen til å oksidere, dehydrere og sulfonar til et bredt utvalg av organiske forbindelser og karbonisere andre.
- Det er en sterk diprotsyre som fullstendig mister sin første proton ved å løse opp i vann og dermed bli dens konjugerte base, bisulfationet (HSO4-). Dette ionet er også en syre, selv om det er svakere enn den opprinnelige syre.
- Vandige svovelsyreoppløsninger er sterkt sure og er i stand til å oppløse mange metaller, og genererer gasshydrogen. De er også i stand til å nøytralisere sterke baser fullstendig.
- Reagerer voldsomt med mange alkoholer og vann, og frigjør store mengder varme i prosessen.
Hvordan oppnås svovelsyre?
De tre mest kjente svovelsyreproduksjonsprosessene er: kontaktprosessen, den våte svovelsyreprosessen og prosessen med blykameraer.
1. Svovelsyresyntese ved kontaktprosessen
Dette er den mest brukte metoden i dag for å produsere svovelsyre. Prosessen består av 5 trinn der elementær svovel blir svoveldioksid (så2), deretter svoveltrioksid (så3), disulfurinsyre (h2S2ENTEN7) og til slutt, i svovelsyre. Reaksjonene som er involvert er:
Kan tjene deg: hva er sikkerhetshombus og hva er det for?
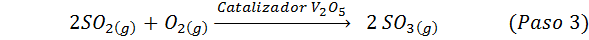


Det andre trinnet i prosessen består ganske enkelt av rensing av svoveldioksid før den blir omdannet til svovel eller svovelanhydridtrioksid. Reaksjonen av det tredje trinnet oppstår når den gassformige svoveldioksid kommer i kontakt med en solid vanadiumpentaoksydkatalysator (V2ENTEN5), Og det er grunnen til at metoden kalles kontaktprosessen.
2. Svovelsyresyntese ved den våte prosessen
Denne prosessen ble designet for å rense utslippsgassene til et bredt utvalg av kjemiske næringer og planter. Biproduktet av denne rensingen er svovelsyre i kommersiell kvalitet i tillegg til varmtvannsdamp, som kan gjenbrukes i den opprinnelige industrielle prosessen.
Når det gjelder den våte prosessen, er reaksjonene stort sett. De viktige reaksjonene som oppstår på hvert trinn er:
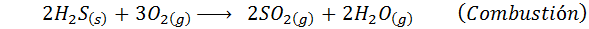
3. Svovelsyresyntese ved prosessen med blykameraer
Dette er en gammel metode for å produsere svovelsyre som brukes i dag veldig lite. Prosessen skulle brenne elementær svovel i nærvær av luftoksygen i blybelagte trekamre, og derav navnet.
Etter denne forbrenningen reagerer svoveldioksid deretter med nitrogenoksider produsert ved nedbrytning av natriumnitrat eller på andre måter. Til slutt, etter en serie med ytterligere reaksjoner, ble svovelsyre oppnådd.
Kan tjene deg: flat bakgrunnsflaskeVanlige applikasjoner
- Hovedpåføringen av svovelsyre er som en kilde til svovel i form av sulfater i fremstillingen av gjødsel. Faktisk er omtrent 60% av svovelsyre produsert i verden ment for dette formålet.
- I den kjemiske industrien brukes den til syntese av vaskemidler, pigmenter, katalysatorer for den petrokjemiske industrien og i behandlingen av mineraler for å oppnå forskjellige metaller.
- Endelig er svovelsyre elektrolytten som brukes i blybatteriene som brukes i de fleste biler.
Risiko forbundet med svovelsyre
På grunn av dens kjemiske egenskaper kan svovelsyre være veldig farlig for både mennesker og dyr og miljøet generelt. Dette er noen av risikoene forbundet med dette kjemikaliet:
- Dens etsende og dehydratiserende egenskaper gjør ren syre forårsaker store skader hvis den kommer i kontakt med huden.
- På den annen side genererer reaksjonen av vandige oppløsninger av svovelsyre med metaller gasshydrogen, som er et drivstoff og eksplosivt stoff.
- Selve svovelsyre lider ikke en forbrenningsreaksjon, men å være en sterk oksidant, stimulerer forbrenningen av andre stoffer, og fungerer som en slags katalysator, så det representerer en betydelig brannrisiko.
- I tillegg, når den blir utsatt for brann, kan den brytes ned i giftige gasser og generere svovelsyre -damper som lett kan ødelegge luftveiene.
Av disse grunner og mer er svovelsyre et stoff som bør håndteres nøye.