Tunsen Munder -egenskaper, funksjoner, eksempler på bruk

- 3474
- 313
- Prof. Theodor Gran
Han Bunsen lettere Det er et laboratorieinstrument som kan levere en varmekilde effektivt og trygt gjennom en flamme, som er et produkt av forbrenning av en gass som vanligvis er metan, eller en blanding av propan og butan. Dette instrumentet i seg selv er synonymt med vitenskap og kjemi.
Hans navn skyldes den tyske kjemikeren Robert Bunsen, som var ansvarlig med treneren Peter Desa, for hans implementering og forbedring basert på en modell som allerede er designet av Michael Faraday. Denne lighteren er liten og lys, så den kan praktisk talt flyttes til et hvilket som helst sted hvor det er en gassflaske og optimale tilkoblinger.
 Bunsen lettere oppvarming av løsningen av en kolbe. Kilde: Sally V/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)
Bunsen lettere oppvarming av løsningen av en kolbe. Kilde: Sally V/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0) Tunsen lighter vises i aksjon. Merk at scenariet ikke engang er et laboratorium. Flammen, blå, varmer innholdet i kolben for å utvikle en kjemisk reaksjon, eller bare for å oppløse en solid raskere. Hovedbruken av dette instrumentet er derfor å bare varme opp en overflate, prøve eller materiale.
Imidlertid brukes Bunsen -lighteren også til en lang rekke metoder og prosesser, for eksempel flammeforsøk, sterilisering, destillasjon, forbrenning og nedbrytning. Siden videregående opplæring har det vært årsaken til forundring og frykt blant studentene, å senere bli et rutinemessig instrument.
[TOC]
Historie
Opprinnelsen til denne ikoniske lettere datoen tilbake til 1854, i et av laboratoriene ved University of Heidelberg, der Robert Bunsen jobbet. Da hadde universitetets fasiliteter allerede et mer rudimentært gass og lettere rørsystem som de utførte eksperimenter.
Imidlertid genererte disse lightere, designet av Michael Faraday, veldig lyse og "skitne" flammer, noe som betyr at de avsatte på overflaten som spilte kullflekker. Disse flammene, i tillegg til å kamuflere fargene som frigjorde visse stoffer når de ble oppvarmet, var ikke varme nok.
Dermed bestemte Robert Bunsen, sammen med den tyske treneren, Peter Drag, å implementere forbedringer i Faraday Lightss. For å oppnå dette søkte de at gassen brant med en høyere luftstrøm, høyere enn den som var fritt rundt laboratoriet. På denne måten ble Bunsen-Disaga Lighter født.
Siden den gang har laboratorier hatt en lighter som lar deg få en mye varmere og "ren" flamme. Takket være denne lettere ble også fundamentene eller opprinnelsen til spektroskopi etablert.
Kan tjene deg: Karbonoider: Elementer, egenskaper og brukKjennetegn og deler av Tunsen lettere
- Instrument
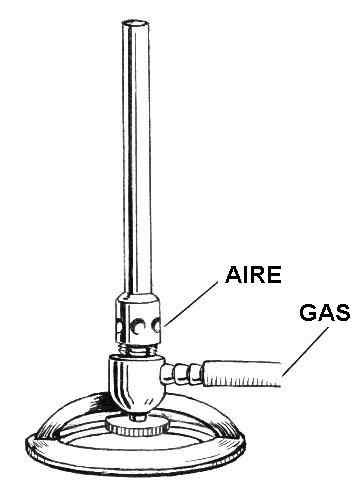 Tegning av delene av bunsen lighter. Kilde: Pearson Scott Foresman / Public Domain
Tegning av delene av bunsen lighter. Kilde: Pearson Scott Foresman / Public Domain I det overlegne bildet har du en illustrasjon av Tunsen lettere. De respektive oppføringene er indikert for både luft og gass.
Gassen løper inne i en gummislange fra gasskranen, som ligger i det samme Laboratory Inn, til den lettere inngangen. I det nedre området av lighteren, rett over ringen -formet støtte, er en ventil eller hjul plassert som nivåer gasstrømmen som vil være utenfor lettere dysen.
Luften derimot kommer inn i lysere gjennom de sirkulære (eller rektangulære) hullene i halskjedet. Når halskjedet er ødelagt, vil mer luft flyte inne i hullene og blande med gassen. Denne luftgassblandingen vil stige langs tønnen eller kolonnen, for endelig å gå ut gjennom lettere dysen.
All lighteren som helhet er laget av et lett metall, for eksempel aluminium, og størrelsen er liten nok til å lagres på hvilken som helst hylle eller skuff.
- Samtaler
Reduktor
 Den flammen oppnådd av bunsen lettere kan variere i farger avhengig av mengden innkommende luft. Kilde: Arthur Jankowski/CC By-SA (http: // CreativeCommons.Org/lisenser/by-SA/3.0/)
Den flammen oppnådd av bunsen lettere kan variere i farger avhengig av mengden innkommende luft. Kilde: Arthur Jankowski/CC By-SA (http: // CreativeCommons.Org/lisenser/by-SA/3.0/) Når en varmekilde er plassert like på høyden av lighterens dyse, enten du bruker en tent eller en gnist, vil luftgassblandingen brenne og forbrenningen vil begynne. Det vil vises da flammen. Imidlertid avhenger de visuelle og kjemiske egenskapene til denne flammen av Aire-gass-forholdet.
Hvis halskjedet er lukket og forhindrer luften mellom hullene, vil det være en gassrik blanding, som vil brenne med oksygenet fra den omkringliggende luften. Denne flammen tilsvarer det 1 (overlegne bildet), og er kjent som flammen "trygg" og "skitten", for å være den minst varme og den som også produserer den største mengden sot. Legg merke til hvor lys det er og også dens guloransje farger.
Lysiteten til denne flammen skyldes at sotpartiklene, tilnærmet sammensatt av karbonatomer, absorberer varme og brannlys og farge og farge. Jo mer åpen gassinngang, jo større vil denne flammen være.
Denne flammen er også kjent for å være en reduksjon, fordi den gir karbon som sotpartikler, som er i stand til å redusere noen stoffer.
Oksidant
Når halskjedet roterer, åpnes hullene som luften åpnes, og øker dermed mengden luft i den resulterende gassformige blandingen. Som et resultat vil den gule flamm.
Kan tjene deg: termisk: struktur, egenskaper, formasjon, eksemplerFlame 4 er den mest ønskede og nyttige i laboratoriet, ettersom det er den hotteste og kan også oksidere prøven som er plassert til din kontakt perfekt. Av denne grunn er denne flammen kjent ved å være oksidant, siden forbrenningsprodukter (i karbondioksid og vanndamp) ikke forstyrrer det omkringliggende oksygenet og stoffene for å oksidere.
Funksjoner/bruksområder
 Lyset Tunsen lettere
Lyset Tunsen lettere Fra forrige seksjon kan det konkluderes med at flammen er det viktigste elementet eller karakteristikken for bunsen lettere. Det er faktisk det som definerer de respektive funksjonene eller bruken av dette instrumentet, som kort sagt ikke er mer enn å varme opp en overflate, materiale eller prøve.
Dette betyr imidlertid ikke at det kan brukes til å varme opp alt på laboratoriet. Til å begynne med må smeltepunktet til materialet være over 1500 ºC, maksimal temperatur som flammen kan nå. Ellers ville det smelte og forårsake en katastrofe i Work Inn.
For det andre er flammetemperaturen så høy, at den er i stand til å sette damper til ethvert organisk løsningsmiddel, noe som vil øke risikoen for brann. Derfor bør bare væsker med høye kokepunkter og lav volatilitet varmes opp.
Det er av denne grunn at vann er et eksempel på en ideell væske for å varme gjennom bruk av Bunsen lettere. For eksempel er det vanligvis hyppig å varme destillasjonsballer, bunnfallskar, kolber eller potter, som inneholder vandige oppløsninger.
Bruk eksempler
Forbrenning
En av hovedbrukene til Bunsen lighter er å sende inn en prøve til forbrenning; det vil si oksidere det raskt og eksotermisk. For å gjøre dette brukes oksidantflammen (blå og nesten gjennomsiktig), og prøven plasseres inne i en beholder som smelting.
Imidlertid flytter de fleste prøver deretter til en mufla, hvor du kan fortsette å varme opp i timevis (selv for en hel dag).
Termisk nedbrytning
Som med forbrenning, å bruke Bunsen lighter. Imidlertid tillater denne metoden ikke den å overvåkes ved fremdriften av nedbrytning etter hvert som tiden finner sted.
Kan tjene deg: dimetylanylin: struktur, egenskaper, syntese, brukFlammeprøve
Metallioner kan oppdages kvalitativt ved flammetesting. For å gjøre dette blir en tidligere oppvarmet og nedsenket ledning i saltsyre satt i kontakt med prøven og tas inne i flammen.
Fargene løsrevet hjelper til med å identifisere tilstedeværelsen av metaller som kobber (blågrønn), kalium (fiolett), natrium (intens gul), kalsium (oransje rød), etc.
Sterilisering av materialer
Flammevarmen er slik at den kan brukes til en annen genial bruk: å ødelegge mikroorganismer på overflaten av materialene. Dette er spesielt nyttig når du arbeider med glass eller metaller som er ment for formål nært knyttet til helse (nåler, pipetter, scalps, etc.).
Destillasjon
Det ble tidligere sagt at vann er en av væskene som helst oppvarmet med Tunsen lettere. På grunn av dette brukes det til å varme opp destillasjonskulene, og dermed koke vannet slik at damper drar noen essenser eller dufter av plantestoff (appelsinskall, kanelstøv, etc.).
På den annen side kan den også brukes til å destillere andre typer blandinger, forutsatt at intensiteten til flammen er moderert og for mange damper genereres i prosessen.
Bestemmelse av kokepunkter
Ved hjelp av Thiele -røret, olje, en støtte og en capilla. Dette eksperimentet er ganske vanlig i undervisningslaboratorier for generell kjemi og organisk kjemi.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2020). Bunsen Burner. Hentet fra: i.Wikipedia.org
- Sammensatt interesse. (31. mars 2016). Kjemihistorie: Bunsen Burner Day. Gjenopprettet fra: Compoundchem.com
- Nikki Wyman. (31. august 2015). Bunsen Burner: Deler, funksjon og diagram. Gjenopprettet fra: Studie.com
- Nichols Lisa. (18. august 2019). Bunsen brennere. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Wayne State University. (s.F.). Riktig bruk av en Bunsen -brenner. [PDF]. Gjenopprettet fra: Forskning.Wayne.Edu

