Halvparten av fundamentet, forberedelse, bruk og begrensninger
- 4083
- 1301
- Prof. Joakim Johansen
Han Halve eller glukosefermentering er en halvfast agar som er spesielt designet for studiet av oksidativ og fermentativ metabolisme av karbohydrater i en viktig gruppe mikroorganismer som er forskjellige fra enterobakterier, kalt ikke-enterérisk negativ bacilli.
Det ble opprettet av Hugh og Leifson; Disse forskerne innså at konvensjonelle medier for studie av syreproduksjon fra karbohydrater ikke var egnet for denne spesifikke gruppen av bakterier.
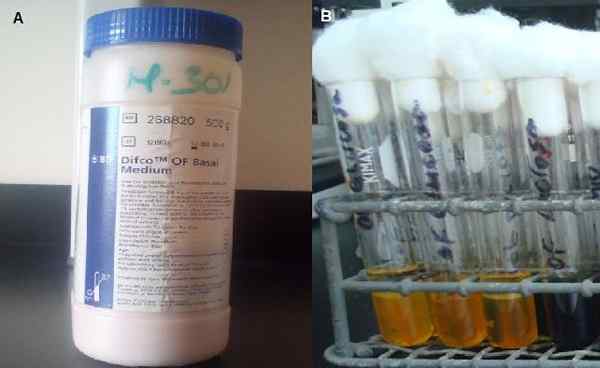
 TIL. Midt i basal kommersiell. B. Rør med halvparten av sådd. Kilde: A- og B -bilder tatt av forfatteren MSc. Marielsa Gil.
TIL. Midt i basal kommersiell. B. Rør med halvparten av sådd. Kilde: A- og B -bilder tatt av forfatteren MSc. Marielsa Gil. Dette er fordi ikke -interiske negative baciller vanligvis produserer lave mengder syrer, i motsetning til enterobakterier.
I denne forstand har mediet spesielle egenskaper som kan oppdage de små mengdene syre dannet, både ved oksidativ og fermentativ. Disse forskjellene er relatert til mengden peptoner, karbohydrater og agar.
Dette mediet inneholder mindre Peptonas og større konsentrasjon av karbohydrater, på denne måten er produktene som alkarerer mediet redusert som et resultat av metabolismen av proteinene og produksjonen av syrer økes ved bruk av karbohydrater.
På den annen side favoriserer reduksjonen i mengden agar formidling av syren produsert av hele mediet, i tillegg til å observere bevegelighet.
Mediet av er sammensatt av pepton, natriumklorid, bromotimolblått, dipotassiumfosfat, agar og et karbohydrat. Det vanligste karbohydratet er glukose, men andre kan brukes i henhold til den du vil studere, for eksempel laktose, maltose, xylose, blant andre.
[TOC]
Basis
Som alle kulturmidler, må miljøet inneholde ernæringsmessige stoffer som garanterer bakterievekst; Disse stoffene er peptoner.
For sin del gir karbohydrat energi og tjener samtidig til å studere atferden til mikroorganismen mot den, det vil si at den gjør det.
Medium for inneholder et pepton/karbohydratforhold på 1: 5 i motsetning til konvensjonelle medier på 2: 1. Dette garanterer at mengden alkaliske aminer som er dannet av nedbrytning av peptoner ikke nøytraliserer dannelsen av svake syrer.
Kan tjene deg: sfingomyeline: hva er, struktur, funksjoner, syntesePå den annen side inneholder mediet natriumklorid og dipotassiumfosfat. Disse forbindelsene stabiliserer osmotisk i midten og regulerer pH henholdsvis. Bromootimol Blue er pH -indikatoren, som gjør fargen på den gule grønne med produksjon av syre.
Noen mikroorganismer kan bruke karbohydrater ved oksidativ eller etter den gjærende ruten, mens andre ikke tar noen av dem.
Dette avhenger av karakteristikken til hver mikroorganisme. For eksempel kan noen strenge aerobe mikroorganismer oksidere visse karbohydrater, og valgfrie anaerober kan oksidere og gjære avhengig av miljøet som omgir dem, mens andre ikke oksiderer eller gjær karbohydrater (ascarolitics).
Endelig er det en modifisering av mediet som anbefales av CDC som inneholder en spesiell base av med rød fenol som indikator.
Oksidasjonsprosess
Glukoseoksidasjonsprosessen krever ikke glukosefosforylering, som forekommer i gjæringsprosessen. I dette tilfellet oksideres aldehydgruppen til en karboksylgruppe, noe som resulterer i glukoninsyre. Dette er igjen oksidert til 2-Zo-glyconic.
Sistnevnte eller to pyruvinsyremolekyler akkumuleres eller ødelegger. Dette systemet trenger tilstedeværelsen av oksygen eller en uorganisk forbindelse som en endelig elektronakseptor.
Produksjon av syrer med denne ruten er svakere enn den som er oppnådd ved den gjærende ruten.
Fermenteringsprosess
For å gjøre glukosefermentering av noen av de tilgjengelige veiene, må den først fosforyleres, og bli glukose-6-fosfat.
Glukosefermentering kan ta flere veier, den viktigste er banen til Embden-Meyerhof-Parna av nedbrytningen av pentose.
Den valgte banen vil avhenge av det enzymatiske systemet som har mikroorganismen.
Via de embden-meyerhof-parna
I gjæringen av glukose av Embden-Meyerhof-parna. Derfra har et mellomstoffstoff opprinnelse, som er pyruvinsyre.
Kan tjene deg: fotoperiodDerfra vil det dannes forskjellige typer blandede syrer som kan variere fra en art til en annen.
Dette systemet oppstår i fravær av oksygen og trenger en organisk forbindelse som en endelig elektronakseptor.
Encoudoroff rute
Ved gjæring av glukose ved intner-ducoroff-ruten, går glukosen 6-fosfat til glukon-ᵼ-lakton-6-fosfat og derfra oksidiseres det til 6-fosfogluvat og 2-ZO-3-Dedexi-6 fosfoglukonat, å endelig danne pyruvinsyre. Dette via trenger oksygen slik at det er glykolyse.
Rute for nedbrytning av pentose eller Warburg-Dikens monofosfat monofosfat via
Denne ruten er en hybrid av de foregående 2. Det begynner å ligne på Entner-Doudoroff-banen, men deretter dannes glyseraldehyd-3-fosfat som en pyruvinsyreforløper, som tilfellet er i banen til Embden-Meyerhof-parna.
Forberedelse
Veie:
2 gr av pepton
5 grn av natriumklorid
10 GR av D-glukosa (eller karbohydrat som kommer til å være forberedt)
0,03 gr bromotimolblått
3 gr av agar
0,30 gr dipotasisk fosfat
1 liter destillert vann.
Bland alle forbindelser bortsett fra karbohydrat og oppløs i 1 liter destillert vann. Varm og rør til den oppløses i sin helhet.
Ved avkjøling ved 50 ° C tilsettes 100 ml glukose til 10% (filtrert).
Fordel på nytt 5 ml av mediet i testrør med bomullslokk og autoklavat ved 121 ° C, 15 kilo trykk i 15 minutter.
La oss i vertikal stilling.
Medium pH må være 7, 1. Fargen på det forberedte mediet er grønn.
Hold i kjøleskapet.
applikasjoner
Mediet er et spesielt middel for å bestemme den metabolske oppførselen til en mikroorganisme mot et karbohydrat. Spesielt for de som danner syrer av en knapp, svak eller null måte.
Sådd
For hver mikroorganisme er det nødvendig med 2 rør med rør, begge må inokuleres med mikroorganismen for å studere. Kolonien er tatt med et rett håndtak og en punktering er laget i midten av røret uten å nå bunnen; Du kan lage flere punkteringer, så lenge du ikke er interessert i å observere bevegelighet.
Kan tjene deg: Alanine: Kjennetegn, struktur, funksjoner, biosynteseTil et av rørene tilsettes et lag med sterilt flytende vaselin eller sterilt smeltet parafin (omtrent 1 til 2 ml) og er merket med bokstaven "F". Det andre røret blir stående original og merket med bokstaven "O". Begge rørene blir inkubert ved 35 ° C og observeres daglig opp til 3 til 4 dager.
Tolkning
Gassmetabolisme og produksjon
Tabell: Klassifisering av mikroorganismer i henhold til deres oppførsel i de åpne (oksidative) og lukkede (fermentative) rørene (Fermentative)
 Kilde: Laget av MSc -forfatteren. Marielsa Gil
Kilde: Laget av MSc -forfatteren. Marielsa Gil Gassen blir observert med dannelse av bobler eller forskyvning av agaren.
Det skal bemerkes at en organisme som bare oksiderer glukose, men ikke gjær, ikke kan gjære andre karbohydrater, i alle fall vil den bare oksidere den. Derfor vil det forseglede røret i denne situasjonen bli utelatt for studiet av andre karbohydrater.
Bevegelighet
I tillegg kan midt i bevegeligheten sees.
Positiv bevegelighet: Vekst som ikke er begrenset til inokulasjonssonen. Det er vekst mot sidene av røret.
Negativ bevegelighet: Vekst bare i den innledende inokulatet.
QA
Som kvalitetskontroller kan du bruke følgende stammer: Escherichia coli, Pseudomonas aeruginosa og Moraxella sp. De forventede resultatene er:
- coli: Glukosefermenter (både gule og gassrør).
- Aeruginosa: Glukoseoksidader (gult åpent rør og grønt eller blå tetning).
- Moraxella sp: Ikke -kjøring (grønt eller blå åpent rør, grønt tetningsrør).
Begrensninger
-Noen mikroorganismer kan ikke vokse i miljøet til. I disse tilfellene gjentas testen, men til mediet 2% serum eller 0,1% av gjærekstrakt.
-Oksidasjonsreaksjoner blir ofte observert nær overflaten, og resten av mediet kan være grønt, på samme måte som det blir tatt som positivt.
Referanser
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. utg. Pan -American redaksjon S.TIL. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12 Ed. Pan -American redaksjon S.TIL. Argentina.
- Mac Faddin J. (2003). Biokjemiske tester for identifisering av bakterier for klinisk betydning. 3. utg. Pan -American redaksjon. Buenos Aires. Argentina.
- Laboratories Francisco Soria Melgizo. 2009. Av glukosemedium. Tilgjengelig på: http: // f-soria.er
- Conda Pronadisa Laboratories. Midt i glukose. Tilgjengelig på: Condalab.com
- BD Laboratories. 2007. Av basal medium. Tilgjengelig på: BD.com

