Metaller
- 2752
- 696
- Prof. Theodor Gran
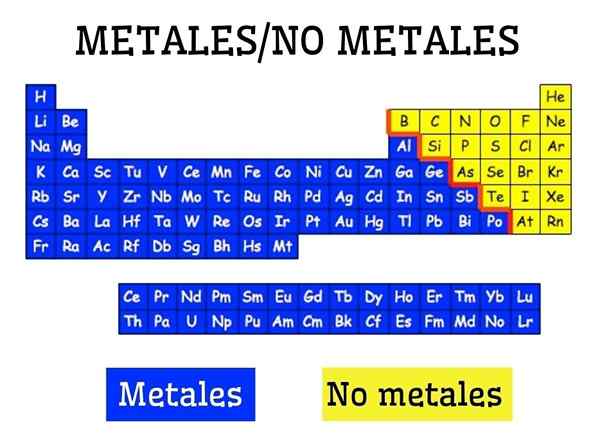
 Metaller og ikke -metaller i den periodiske tabellen til elementene
Metaller og ikke -metaller i den periodiske tabellen til elementene Hva er metaller?
Metaller dannes av en gruppe elementer som er plassert på venstre side, med unntak av det ikke -metalliske hydrogenet, av det periodiske tabellen. Metaller utgjør omtrent 75 % av kjemiske elementer, så det kan sies at mye av naturen er metallisk.
Metallene som mennesket opprinnelig ble tiltalt i forhistorien, var følgende: gull, sølv, kobber, tinn, bly og jern. Dette skyldtes det faktum at de var innfødte eller lettheten av behandlingen for å utføre verktøyobjekter.
Det virker som om et spørsmål om magi at mange bergarter og mineraler kan trekkes ut skinnende og sølvlegemer (med visse viktige og fremragende unntak). Slik er tilfellet med bauxitt og aluminium, hvis leire bergarter dette metallet reduseres i plater eller sølvpapirer er oppnådd.
Metaller er rammen for næringer; Deres ledninger, reaktorer, enheter, containere, alt på en eller annen måte er sammensatt av metaller og legeringene deres.
Med metaller ble de første myntene, våpen, verktøy, rustning laget og deretter brukt i kjøretøyprodusenter, sykler, skip, fly, datamaskiner, blant andre uunnværlige gjenstander i det moderne liv.
Historie
Kobberalder
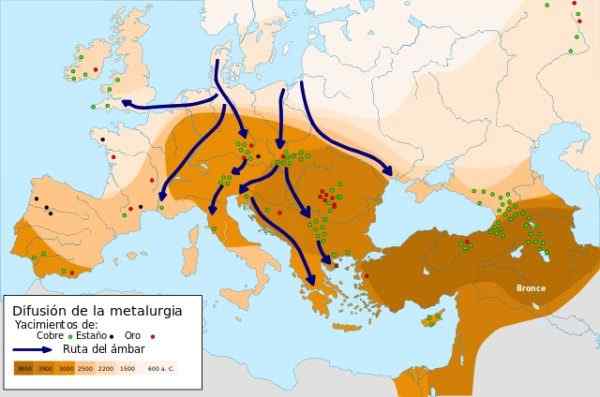 Metallurgiutvidelse - Kilde: Metallurgisk diffusjon.SVG under Creative Commons Attribution-Compartyrigual 4 License 4.0 Internasjonalt
Metallurgiutvidelse - Kilde: Metallurgisk diffusjon.SVG under Creative Commons Attribution-Compartyrigual 4 License 4.0 Internasjonalt I 9000 a.C. De første metallgjenstandene med kobber smidd i nær øst ble utdypet, da mannen oppdaget at da kobberet hamret han, økte han styrken og motstanden, ved å bruke den til fremstilling av kniver. Dette er kobberens alder.
Det ble oppdaget at kobber kunne oppnås gjennom oppvarming av blå mineraler, for eksempel Corvellita og Malachite (4000-3000 til.C.).
Den kalsolitiske perioden er en periode som går foran bronsealderen, tilsvarende 5000-3000 til.C. Mannen begynte å eksperimentere med fusjon og støperi av kobber, for å få kobber smidd fra kobberoksid.
Bronsealder (3000-1500 a.C.)
 Bronze Age Materials - Kilde: Gaguilella under Creative Commons Attribution -Shareigual 4 License 4.0 Internasjonalt.
Bronze Age Materials - Kilde: Gaguilella under Creative Commons Attribution -Shareigual 4 License 4.0 Internasjonalt. Mannen begynte ved et uhell å utdype legeringer, opprinnelig av kobber og arsen, og deretter med kobber og tinn for å få bronse i nær øst.
Bronseartikler, tilsvarende denne tiden, hadde 87 % kobber, 11 % tinn og små mengder jern, arsen, nikkel, bly og antimon.
Jernalder (700 a.C.)
Mannen brukte sin erfaring i produksjonen av smidd kobber for produksjon av smijern i det nærmeste Østen. I samme periode var det granulering av Etrusco Dust, Italia.
Den første kjente stålproduksjonen, en jern- og karbonlegering, manifesterte seg i metallstykker på et arkeologisk sted i Anatolia (1800 til.C.)
Kan tjene deg: gravimetri: gravimetrisk analyse, metoder, bruksområder og eksemplerMot 1122 d.C., På en ukjent dato og sted blir støpejern introdusert. I 1440 d.C. Beijings store bjelle er produsert, Kina. Nesten tre århundrer senere, i 1709 d.C., støpejern produseres ved hjelp av koks som brennbart materiale.
I 1779 ble støpejern i England brukt som arkitektonisk materiale. I 1855 brukte Henry Bessenir Arrabio som råstoff for å oppnå mykt stål. Den engelske Clark og Wood (1872) patenterer en legering, for tiden betraktet som rustfritt stål.
Fysiske egenskaper til metaller
 Bronsen av disse eldgamle klokkene demonstrerer nytten av metaller for pryd eller religiøse formål. Kilde: Pxhere.
Bronsen av disse eldgamle klokkene demonstrerer nytten av metaller for pryd eller religiøse formål. Kilde: Pxhere. Blant noen fysiske egenskaper til metaller har vi:
-Metaller er strålende og klarer å gjenspeile lyset.
-Generelt er de gode ledere av strøm og varme.
-De har høye fusjons- og kokepunkter.
-De er formbare, det vil si at de kan bli hamret for å produsere lave tykke ark.

-De er duktile, med dem kan du produsere ledninger eller fibre med veldig liten diameter.
-De presenteres i en fast tilstand, med unntak av kvikksølv som ved romtemperatur er i flytende tilstand, og gallium, som smelter bare ved å stramme i hendene i hendene. I følgende bilde kan du se en kvikksølvbeholder:

-De er ugjennomsiktige kropper, deres tynne ark blir ikke krysset av lyset.
-De har stor hardhet, bortsett fra natrium og kalium som kan kuttes av en kniv.
-De har en høy tetthet, er osmium og iridium av det høyeste, og litium av lavest tetthet.
Kjemiske egenskaper til metaller
Blant noen av de kjemiske egenskapene til metaller har vi:
-De har en tendens til å miste elektroner og danne metallkationer, mn+, der n indikerer sitt oksidasjonsnummer, som bare for alkaliske og alkalistiske metaller sammenfaller med dets valensnummer.
-Elektronegativitetene er lave.
-De løper og opplever oksidasjonsskader.
-De danner grunnleggende oksider når de reagerer med oksygen. Disse oksydene når de kombineres med vann danner metallhydroksider. Metalloksider reagerer med syrer for å danne salter og vann.
-De er gode reduksjonsmidler, siden de gir elektronene sine.
Typer metaller
Metaller er klassifisert som følgende: alkalisk, alkalisk-rettssak, post-transitional, overgangs- og såkalt sjeldne jordarter.
Alkalimetaller

De finner seg vanligvis ikke frie i naturen fordi de oksiderer seg lett. Har en suborbital s1 I det ytre orbitallaget, så de har en oksidasjonstilstand +1. De er metaller som reagerer eksotermisk med vann og reduserer sterkt.
Alkalisk-térreos metaller
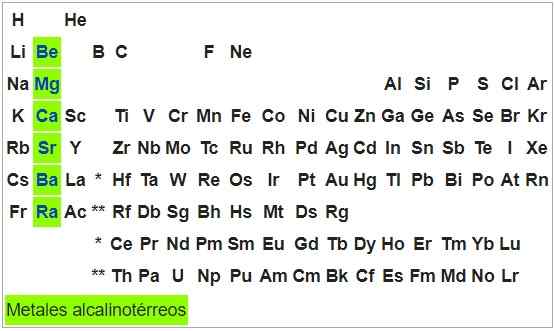
De er formbare og duktile metaller. Atomene i elementene i denne gruppen har en konfigurasjon2, Så de kan gi to elektroner og oksidasjonsstatusen deres er +2. Med unntak av beryllium er de oksidable for lufteksponering.
Kan tjene deg: karbonalotroperPosttransitional metaller
De er metaller av den såkalte P -blokken, som ligger mellom overgangsmetaller og metalloider i det periodiske tabellen.
Elementene i gruppe 3 har oksidasjonstilstander +1 og +3 som det vanligste, selv om aluminium bare presenterer oksidasjonstilstanden +3. Det er også en del av post -overgangsmetaller som ligger i gruppe 14 og 15.
Overgangsmetaller d
De danner en gruppe mellom baseformende elementer og syreformatorer. Atomic orbitals D og F er ufullstendige og blir fylt. Selv om begrepet overgangsmetaller refererer til overgangsmetaller d.
Overgangsmetaller har mer enn en oksidasjonstilstand. De har fusjons- og kokepunkter høyere enn andre metallgrupper. Overgangsmetaller er en veldig heterogen metallgruppe som inkluderer blant annet jern, krom, sølv, etc.
Sjelden jord
 Sjelden jordmineral
Sjelden jordmineral Denne gruppen av metaller består av elementene Scandio og Ititrio og elementene i serien med lantanider og actinider. Begrepet 'sjelden jord' refererer til det faktum at de ikke finnes i naturen i rene tilstander og er festbare av syrer.
Bruker/applikasjoner av metaller
Alkalimetaller
Litium brukes som varmeoverføring betyr i noen atomreaktorer. Det brukes i noen tørre batterier og akkumulatorer med liten vekt. Klorid og litiumbromid er hygroskopiske forbindelser som brukes i industriell tørking og klimaanleggsprosesser.
Natrium brukes i metallmetallurgi, for eksempel titan og zirkonium. Det brukes i offentlig belysning i natriumbue -lamper. Natriumklorid (NaCl) brukes som en matsmak og kjøttbevaring.
Alkalineter metaller
Magnesium ble brukt i fotografering som flashlys og fyrverkeri. Barium er en komponent av legeringer som brukes i tennplugger på grunn av det enkle elementet for å avgi elektroner. Bariumsalter brukes til å begrense skaden forårsaket av x -stråler i mage -tarmkanalplater.
Kalsium brukes til å eliminere urenheter oppløst i smeltede metaller og ved eliminering av restgasser i vakuumrør. Det er en del av gipsen, materiale som brukes i konstruksjon og i behandlingen av beinbrudd.
Posttransitional metaller
Aluminium fordi det er et lett metall brukes i konstruksjonen av fly og kar. Det brukes også til utdyping av mange kjøkkenutstyr. Det brukes som råstoff i fremstilling av deodoranter som begrenser svette.
Kan tjene deg: Prosentvis løsningerGallium brukes i transistorer og termometre for høye temperaturer. Isotopen 67GA brukes i medisin i behandlingen av noen melanomer. Bly brukes i konstruksjon av batterier og i beskyttelse mot ioniserende stråling.
Overgangsmetaller
Kobber brukes i vannforsyningsrør, i kjøleskap og klimaanlegg. Det brukes også som en del av datamaskinens varmeavvisningsmekanisme. Det brukes i ledningen av elektrisk strøm, i elektromagneter og i fargelegging av glass.
Nikkel brukes til utdyping av rustfritt stål, så vel som gitarstrenger og oppladbare batterier. Det brukes også i galvanoplastikk i metallbeskyttelse. Det brukes i legeringer som finnes i deler av kjøretøyer, for eksempel ventiler, lagre og bremser.
Nikkel har blitt brukt, i lang tid i utdyping av mynter.
Sink brukes i korrosjonsmetallbeskyttelse, i messingproduksjon. Sinkoksid og sinksulfat brukes til fremstilling av plater som brukes i tak, takrenner og nedløp.
Krom brukes i metallkorrosjonsbeskyttelse og forsyninger skinner. Det brukes som en katalysator i ammoniakksynteseaksjonen (NH3). Kromoksid brukes i trebeskyttelse.
Sjelden jord
Scandio brukes i aluminiumsaluminium for luftfartskomponenter. Det er et tilsetningsstoff i kvikksølvdamplamper.
Lantano brukes i høy refraksjon og alkalis -resistent glass. I tillegg brukes det i fremstilling av kameraer og som en katalytisk katalysatorvæsker for oljeraffinerier.
Cerio brukes som et kjemisk middel. I tillegg brukes det til tilførsel av gult glass og keramisk farge, samt katalysator for selvtegnfulter.
Eksempler på metallelementer
Alkalisk
Natrium (Na), kalium (K), Cesio (CS), litium (Li) og Rubidium (RU).
Alkalisk-terreos
Beryllium (Be), Magnesium (Mg), Calcium (CA), Strontium (MR), Barium (BA) og Radio (RA).
Posttransitional
Aluminium (AL), Gallium (GA), Indian (In), Talio (TL), Tin (SN) og bly (PB).
Overgang
Titan (Ti), Vanadium (V), Chrome (CR), Mangan (MN), Iron (Faith), Cobalt (CO), Nickel (Ni), Copper (Cuinc), Zinc (Zn), Zirconium (ZR), Niobio (NB), Molybden (MO), Paladio (PD), Silver (AG), Volframium (W), Renio (RE), Osmio (OS), Iridido (IR),
Platinum (PT), gull (AU) og Merkur (HG).
Sjelden jord
Scandio (SC), Itrio (Y), Lantano (LA), Cerio (CE), Praseodimio (PR), Neodymium (ND), Samarium (SM), Europio (EU), Gadolinio (GD), Holmio (HO), Erbio (ER), Tulio (TM), Iterbio (YB) og Luthacio (LU).
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Helmestine, Anne Marie, PH.D. (5. oktober 2019). Metaller kontra ikke -metaller. Gjenopprettet fra: Thoughtco.com
- Metaller og deres egenskaper-fysiske og kjemiske. [PDF]. Gjenopprettet fra: CSUN.Edu
- Jonathan Master. (2019). 18 forskjellige typer metall (fakta og bruksområder). Gjenopprettet fra: makeitfrommetal.com

